izotermája 25 oC-on, 3 órás rázással
Magyar Kémikusok Lapja, 45. évfolyam, 3–4. szám, 1990
Ciklodextrinek és zárványkomplexeik a biotechnológiában és a vegyiparban
SZEJTLI JÓZSEF
Részletek a cikkbôl
Ciklodextrinek a biotechnológiában
Ha egy vízben rosszul oldódó apoláros szerves vegyület ("vendégmolekula") vizes szuszpenziójához ciklodextrint ("gazdamolekula") adunk, akkor (amennyiben a komplexképzés egyéb feltételei fennállnak) növekedni fog az oldott vendégmolekula koncentrációja. Ha a rendszerben a vendégmolekula teljes egészében oldva van, akkor a ciklodextrin hozzáadása azt eredményezi, hogy az oldott vendégmolekuláknak csak egy része marad "szabad", másrésze komplexbe lesz zárva és ennek következtében a már ismertetett változásokon kívül még egy fontos sajátsága megváltozik: affinitása a sejtmembránokhoz, tehát pl. a toxicitása. Mivel a ciklodextrinek az enzimekre (kivéve az amilolitikus enzimeket) és a mikroorganizmusokra közvetlenül hatást nem gyakorolnak, a mikrobiológiai vagy enzimes folyamatokat meg lehet valósítani ciklodextrin-oldatokban, a megszokottaknál magasabb összes oldott szubsztrát koncentrációknál, ugyanakkor alacsonyabb szabad szubsztrát (kevésbé inhibitáló vagy kevésbé toxikus) koncentrációknál. Ezt szemléltetik a következôkben felsorolt példák.
A bioszintetikns aktivitás fokozása
A pertussis-toxin (=leukocitozis promoting faktor, LPF-hemaglutinin) egyike a fô védôantigéneknek a szamárköhögés ellen. Ezt a Bordatella pertussis termeli. Egy kevésbé reaktogén vakcina termeléséhez szintetikus táptalaj szükséges, de a pertussis-toxin termelése meglehetôsen nehéznek bizonyult szintetikus táptalajon, különösen rázott kultúrákban. A Bordatella pertussis nagyon érzékeny számos inhibitorral, pl. zsírsavakkal (palmitin- vagy oleinsav) szemben, már 10µM koncentráció leállítja a sejtszaporodást [5]. Hozzáadva azonban 0,5 mg/ml dimetil-béta-ciklodextrint (vagy trimetil-béta-ciklodextrint9 fokozott sejtnövekedést lehet megfigyelni, továbbá a pertussis-toxin termelés százszorosáig fokozódott [6,7]. Az eljárást már több országban (Japán, Kanada) alkalmazzák iparilag. A filamentozus hemaglutinin termelése még nagyobb mértékû, néhány százszoros volt a dimetil-béta-ciklodextrin jelenlétében [7]. A Mycobacterium phlei (=M. smegmatis) zsírsav-termelését a ciklodextrinek és különösen a metilezett ciklodextrinek igen jelentôs mértékben megjavítják [8].
A lankacidin csoporthoz tartozó antibiotikumok termelését a béta-ciklodextrin jelenléte jelentôsen megjavította. 11 mM béta-ciklodextrint adva a Streptomyces rochei volubilis tenyészetet tartalmazó fermentorba a lankacidin A és C termelése 0,05, illetve 0,04 mM-ról 0,55 és 4,6 mM-ra növekedett. Béta-ciklodextrin hozzáadása nélkül a fermentáció végére mindössze 0,4 mg/ml lankacidin C koncentrációt sikerült elérni, míg a ciklodextrinnel ez elérte a 3,1 mg/ml-t. A béta-ciklodextrin nem gyakorolt észrevehetô hatást a sejtszámra, a szénforrás fogyasztási sebességére, vagy A pH-ra és maga a béta-ciklodextrin sem metabolizálódott. A keletkezett antibiotikumot béta-ciklodextrin komplex fomájában lehet izolálni [9].
Mikroorganizmusok által végzett biokonverziós folyamatok
 |
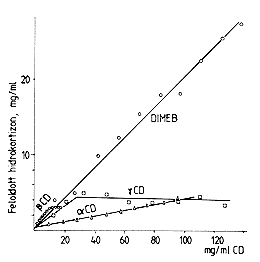
| 5. ábra. A hidrokortizon oldékonysági izotermája 25 oC-on, 3 órás rázással |
Az 5. ábra szemlélteti a hidrokortizon oldékonyságát különbözô ciklodextrin oldatokban. A dimetil-béta-ciklodextrin (egyelôre) túlságosan drága ipari célokra, de nagyon jelentôs javulást lehet elérni a hidrokortizonnak a prednizolonná történô mikrobiológiai konverziójánál, amely a béta-ciklodextrin oldatban megfigyelhetô látszólag kismértékû oldékonyság fokozásán alapszik. A hidrokortizon oldhatósága vízben mindössze 0,4 mg/ml, ezért nagy térfogatokban viszonylag csak kis mennyiségeit lehetett ennek a szteroidnak konvertálni mikrobiológiai úton. A konverziós folyamat lassú, és a végtermék nem volt homogén, mert keverék kristály is képzôdött (hidrokortizon + prednizolon). Ezt a folyamatot vizes béta-ciklodextrin oldatban megvalósítva a kapacitás tôbb mint 300%-kal fokozódott. A hidrokortizon oldékonysága növekszik, 3–4-szer több hidrokortizont lehet betáplálni egy konverterbe, a reakció gyorsabb és a végtermék homogénebb. Az elvet a 6. ábra szemlélteti. Ezt az eljárást már alkalmazza a Kôbányai Gyógyszerárugyár [10].
Gyakorlatilag minden mikrobiológiai szteroid konyerziós folyamatot kipróbáltak már vizes ciklodextrin oldatokban, minden esetben igéretes eredményekkel. A cholesterin Mycobacteriummal végzett mikrobiológiai konverziója androst-4-én-3,17-dionná 180 óra alatt nem ért el jobb kitermelést, mint 40%-ot a koleszterinre vonatkoztatva. A biokonverzió termékgátolt, és a szteroid gyûrû is degradálódik. Béta-ciklodextrin jelenlétében 96%-os kitermeléssel sikerült a konverziót rövid idô alatt megvalósítani [11].
A ciklodextrin stimuláló hatását megfigyelték aromás aldehideknek élesztôkkel aromás alkoholokká történô biotranszformációjánál is. Mind a kitermelés, mind a folyamat sebessége jelentôsen megjavult [12].
...
Ciklodextrinek a szennyvíz detoxikálásában
A toxikus szerves vegyületek széles köre (hidroxi-, halogeno-, nitro-, amino- stb. aromás és alifás származékok) található a szerves vegyipar és a gyógyszeripar szennyvizeiben. A biológiai szennyvíztisztítás azt jelenti, hogy ezeket a toxikus vegyületeket bizonyos élesztôk és baktériumok degradálják, amelyek a biológiai ún. élôiszapban találhatók. Ezek a mikroorganizmusok a toxikus vegyületeket csak akkor tudják elviselni, ha azok koncentrációja nem halad túl egy kritikus szintet, ez alatt a toxikus anyagokat metabolikus folyamatok révén nem-toxikus anyagokká konvertálják. Megfelelô adaptációs eljárásokkal a toxikus anyagok tolerábilis koncentrációját lehet fokozni, de ha ezt a kritikus koncentrációszintet túllépik – akárcsak rövid idôre is – akkor az említett mikroorganizmusok elpusztulnak, azaz az élôiszap detoxikáló kapacitását irreverzibilis károsodás éri. Az ilyen biológiai rendszerek regenerálódása nem gyors folyamat. Ezért a detoxikáló kapacitás megôrzése az élôiszapban a környezetvédelem egyik elsôrendû célja.
Az ilyen kritikus vagy kritikus feletti koncentrációkat úgy lehet például elkerülni, hogy a toxikus anyagokat tartalmazó szennyvizet olyan vízzel vagy szennyvízzel hígítják, amelyik ilyen anyagot nem tartalmaz. Ily módon lehet redukálni a toxikus anyag koncentrációját. Néha az ilyen hígítás több ezer köbméter toxikáló anyagtól mentes vizet igényelne, ami nem mindig áll rendelkezésre.
Az ilyen vizekhez ciklodextrint adva – amelynek természetesen nem kell tisztának lennie, a legolcsóbb technikai minôség is megfelelne a célra – az említett organikus toxikus vegyületek számottevô része komplexálódik [21, 22, 23]. A komplexált molekulák nem tudnak behatolni a sejtmembránon keresztül, ezért nem toxikusak. Ily módon a szabad toxikus anyagkoncentráció erôsen redukálódik a kritikus koncentrációszint alá. Amint ez a koncentráció csökken a metabolikus folyamatok révén, a ciklodextrin komplexek mint dinamikus tartalékok viselkednek: szabadon eresztik a bezárt toxikus molekulákat, és ezt az egész folyamatot a disszociációs egyensúly határozza meg (6. ábra). ...

6. ábra. Ciklodextrint adva a toxikus p-nitro-klór-benzolt tartalmazó szennyvízhez, a ciklodextrin a vegyület egy frakcióját kompenzálja. A ciklodextrin-komplex – lévén hidrofil – kisebb afiinitással rendelkezik a lipoprotein sejtmembránokhoz, ezért kevésbé toxikus a mikróba sejtekre. Csak a nem komplexált frakció hat a sejtmembránon.
A ciklodextrin-üreg mint molekuláris méretû reaktor
A ciklodextrin-üregbe zárt "vendégmolekula" függetlenül attól, hogy a komplex szilárd kristályos fázisban vagy oldott állapotban van, mérsékelten apoláros közegben, nem hidratált állapotban van, anélkül, hogy más, hasonló molekulával érintkezhetne. Így polimerizáció, diszproporcionálódás, oxidáció nem történhet, viszont olyan reakciók, amelyekben a ciklodextrin-hidroxilok szerepet játszhatnak, jelentôsen felgyorsulnak. A ciklodextrinek önmagukban is, de különösen megfelelô módon szubsztituált származékaik formájában enzimmodellként viselkednek. Ennek már eléggé széleskörû irodalma van, itt azonban csak olyan reakciókra szándékozunk röviden utalni, ahol a ciklodextrin molekula nem enzimmodell, hanem a ciklodextrin-üreg mint valamely reakció lejátszódásának a helyszíne, azaz mint molekuláris méretû reaktor viselkedik. Különösen a terner komplexek esetében van ez így, azaz, amikor a "fô" vendégmolekula mellett még egy kisméretû, reaktív második vendégmolekula is belép az üregbe: ilyen esetben gyors és nagymértékben szelektív reakciókra számíthatunk [3].
Regioszelektív halogénezés
 |
| 7. ábra. Az anizol ciklodextrin jelen- létében történô szelektív p-klórozá- sának valószínû mechanizmusa |
Anizolt vizes oldatban klórozva kb. 40% orto- és 60% para-klór-anizol képzôdik. Ha a vízben alfa-ciklodextrint oldunk, akkor annak koncentrációjával arányosan nô a keletkezô para-klór-anizol aránya [25]. A reakció úgy is megvalósítható, hogy ciklodextrin térhálósításával elôállított polimerben kötjük az anizolt, majd ezt az anizollal telített polimer-oszlopot hipoklorit oldattal mossuk át. Ilyen esetben a para-klór-anizol aránya a 99%-ot is meghaladja [26]. Ciklodextrint immobilizálva grafitelektródok felületén az anizol [27]vagy a toluol [28] anódos klórozása ugyancsak a para izomer keletkezését fokozza. A reakció elsô lépése az, hogy a klóratom a ciklodextrin gyûrû primér hidroxiljával lép reakcióba (7. ábra), majd az oxigénatomon kötött klór támadja az aromás gyûrû nem fedett para pozícióját. Az orto és meta pozíció a ciklodextrin gyûrû által fedve van.
Reimer-Tiemann formilezés és karbozilezés
Alkálikus vizes oldatban oldott fenolhoz kloroformot, vagy rézpor katalizátort és széntetrakloridot adva a para- és az orto helyzetben aldehid-, illetve karboxilcsoport épül be. A reakciót ciklodextrin jelenlétében megvalósítva nagyfokú szelektivitással csak a para helyzetben történik szubsztitúció. A reakciónak az a mechanizmusa, hogy a ciklodextrin-üregbe a fenolmolekula az apoláros részével félig helyezkedik be, az alatta lévô hely azonban alkalmas arra, hogy a halogénezett szénhidrogénbôl keletkezô kation ugyancsak beépüljön és úgy jön létre a szelektív para szubsztitúció [29,30] (8. ábra).

8. ábra. p-Hidroxi-benzaldehid szintézis ciklodextrin jelenlétében
Diels-Alder reakció
A ciklopentadién és acetonitril kondenzáció sebessége 9-szeresére fokozódik béta-ciklodextrin jelenlétében, de kb. 20%-kal lassul alfa-ciklodextrin jelenlétében. Molekulamodellek tanulmányozásával megállapftható, hogy míg a béta-ciklodextrinbe mindkét komponens befér, addig az alfa-ciklodextrin üreg túl kicsi ahhoz, hogy mindkét komponenst egyidejûleg magába tudja zárni [31].(9. ábra).

9. ábra. A ciklopentadién és az akril-nitril
közötti Diels-Alder reakciót
az alfa-cikodextrin gátolja, a béta-ciklodextrin gyorsítja
Eliminációs reakciók
A ciklodextrinek vizes közegben katalizálják a metil-fenil-cianoecetsav, a szubsztituált acetecetsavak és trihalo-ecetsavak dekarboxilezôdését [32]. Ez a katalitikus hatás azonban erôsen függ a körülményektôl. Pl. foszfátpufferben mind az alfa-, mind a béta-ciklodextrin katalizálja a benzoil-ecetsav dekarboxilezôdését, mivel a disszociált anionnal mindkét ciklodextrin hasonló módon lép kölcsönhatásba; pH3 körül azonban már zömmel a nem-ionizált sav veszíti el karboxilcsoportját, és ekkor már csak a béta-ciklodextrinnek van katalizáló hatása, az alfa-ciklodextrin ellenkezôleg, stabilizálja a molekulát. Ezt konformációs hatással lehet magyarázni. A béta-ciklodextrin üregbe a vendégmolekula feszültséggel rendelkezô konformációban tud behelyezôdni. Az alfa-ciklodextrin oly mértékben korlátozza a molekula mozgási szabadságát, hogy nem reaktív konformációba kényszeríti a molekulát.
Jelentôs és egyre növekvô számú publikáció foglalkozik a fentiekhez hasonló megfigyelések leírásával, és már több szabadalom is foglalkozik az ilyen lehetôségek esetleges ipari hasznosításával.
IRODALOM
(1) French, D.: Adv. Carbohydrate Chem., 12 189 (1957).
(2) Szejtli, J.: "Cyclodextrins and Their Inclusion Complexes"
Akadémiai Kiadó, Budapest, 1982.
(3) Szejtli, J.: Cyclodextrin Technology, Kluwer Academic Publ.,
Dordrecht, 1988.
(4) Himyama, F. - Uekama, K.: in "Cyclodextrins and their Industrial
Uses, (Ed.: Duchéne, D.), Editions de Santé, Paris, 1987.
(5) Suzuki, Y. - Imaizumi, A. - Sato, H. - Sato, Y.: Ipn. J. Med.
S. 96 111 (1983).
(6) Imaizumi, A. - Suzuki, Y. - Onoa, S. - Sato, H. - Sato, Y.: Infection
and Immun. 41 1138 (1983).
(7) Suzuki,Y. - Imaizumi, A. - Ono, S. - Sato, H. - Sato, Y.: Abstract
Book of 3rd Int. Symp. Clathrate Comp. and 2nd Int. Symp. on Cyclodextrins,
Tokyo, (1984) July 23-27.
(8) Bergeron, A. R. - Machida, Y. -Bloch, K.: J. Biol.
Chem. 250 1223 (1975).
(9) Sawada, H. - Suzuki, T. - Akiyama, S. - Naka, Y.: Appl. Microbiol.
Biotechnol. 26 522 (1987), C. A. 107:196443.
(10) Udvardy, N. É. - Bartha, I. - Hantos, G. - Trinn, M.
- Vida, Za. - Szejtli, J. - Stadler-Szóke, Á. - Habon, I.
- BaIázs, M.: (Richter Gedeon) Belg. Pat. (1983) 894, 501, C.
A. 99:4069.
(11) Hesselink, P. G. M. - de Vries, H. - Witholt, B.: in Proceedings
of the 4th European Congress on Biotechnology. (1987) Vo.2. (Neijssel,
O. M., van der Meer, R. R. and Luyben, K. C. A. M., eds), Elsevier, pp.
299.
(12) Bar, R.: Trends in Biotechnol. 7 2 (1989).
(13) Szejtli, J. - Szente, L. - Kálói, K. - Marton, J.
- Gerlóczy, A.: Hung. Pat. Appl. 75/85.
(14) Gerlóczy, A. - Szente, L. - Szejtli, J. - Fónagy,
A.: in Inclusion Phenomena in Inorganic Organic, and Organometallic
Hosts (Eds.: J. L. Atwood, J. E. D. Davies), Reidel Publ. Co., Dordrecht,
1987. p. 415.
(15) Singh, I - Singh, R. - Bhuahan, A. - Singh, A. K.: Arch. Biochem.
Biophys. 296 418 (1985), C. A. 102:91817.
(16) Nánási, P. - Lenkey, B. - Szejtli, J.: Nem publikált
eredmények (1980).
(17) Yamane, l - Kan, M. - Minamoto, Y. - Amatsuji, Y.: Proc. Jpn.
Acad. Ser. B. 57 385 (1981), C. A. 96:100488.
(18) Yamane, l - Kan, M. - Minamoto, Y. - Amatsuji, Y: Cold Spring
Harbon Conf. Cell Proliferation (1982) p. 87, C. A. 97:212006.
(19)Ajinomoto Co.: Jpn. Kokai (1982) 82, 194, 787, C. A. 98:124208.
(20) Szejtli, J. - Stadler-Szôke, Á. - Vikmon, A. - Pivkovich,
S. Inczefy, l - Kulcsár, G. - Zlatos, G.: Hung. Pat. 4508/83
(1983).
(21);í 0láh, J. - Cserháti, T. - Szejtli,
J.: Magyar Kémikusok Lapja .43 104 (1988).
(22) Farkas, P. - 0láh, J. - Szejtli, J. - Szente, L. - Cserháti,
T.: Hung. Pat. (1984) 2650/84.
(23) Oláh, J. - Cserháti, T. -Szejtli, J.: Water Res.
22 1345 (1988).
(24) Bánky, B. - Recseg, K. - Novák, B.: Magy. Kém.
Lapja 40 189 (1985).
(25) Brealow, R. - Campbelt, P.: Bioorg. Chem. 1 140 (1971).
(26) Brealow, R. - Kohn, H. -Siegel, B.: Tetrahedron Lett. 20
1645 (1976).
(27) Kuhera Chem. Ind. Co.: Jpn. Kokai (1980) 80, 85, 684, C. A.
93:194463.
(28) Osa, T. - Fujihara, M. - Matuae, T. - Senda, J. M. Yamamuchi, T.:
Kuhera Chem. Ind. Co. (1980), Ger. Offen 2, 951, 503, C. A.
93:103846.
(29) Hirai, H. - Komiyama, M. (Asahi Chemical Induatry Co.)
PCT Int. Appl. (1982) WO 8203073, 16 .09. 1982, C. A. 98:71670.
(30) Komiyama, M. - Hirai, H.: Makromol. Chem. Rapid Commun.
2 661, (1981), C. A. 96:34749.
(31) Bneelow, R.: in: "Inclusion Compounds" (1984), Vol.
3. (Eds.: J. L. Atwood, J. E. D. Davies, D. D. MacNicol), Academic Press,
London, 1984. p. 473.
(32) Cmmer, F. - Kampe, W.: J. Am. Chem. Soc. 87 1115 (1965).
| Vissza az Elôadóba | http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |