Faraday-típusú folyamatok. Galváncella és elektrolizáló cella
Azok az elektrokémiai cellák, amelyeken át Faraday-áram folyik, galváncellák vagy elektrolizáló cellák lehetnek. A galváncellában a kémiai reakció spontán megy végbe az elektródokon, amelyek külsô áramkörben, fémes kontaktussal csatlakoznak. Ezt a cellafajtát gyakran használják arra, hogy a kémiai energiát elektromos energiává alakítsák. Gyakorlati fontosságú példa a Leclanché-féle Zn–MnO2 elem, a tölthetô Pb–PbO2 ólomakkumulátor vagy a H2–O2 tüzelôanyag-cella. Az elektrolizáló cellában külsô forrásból az elektródokra a reverzibilis cellapotenciálnál nagyobb feszültséget adunk: elektromos energia felhasználásával kémiai reakciókat viszünk végbe. Ipari fontosságú példa néhány anyag elôállítása (Cl, Al), a réz tisztítása vagy a fémbevonatok (Ag, Au) készítése lehet. Az ólom-szulfátos akkumulátor – töltés közben – ugyancsak elektrolizáló cellaként mûködik.
Gyakorlati szempontból fontos tehát a galváncellák és az elektrolizáló cellák megkülönböztetése, de a reakciók vizsgálatánál gyakran csak egyetlen elektródon zajló folyamatokra (egy félcellára) összpontosítjuk figyelmünket. A félcellában zajló folyamatok jellege és természete független attól, hogy az elektród galván- vagy elektrolizáló cellában van-e. Vegyük példaként a 2. ábrán látható cellákat. A Cu2+ + 2e ® Cu reakció természete mindkét cellában azonos. Ha rezet szeretnénk leválasztani, ezt megtehetjük galváncellában (úgy, hogy másik elektródként a Cu/ Cu2+ párénál negatívabb standard potenciálú rendszert választunk) vagy elektrolizáló cellában (szinte tetszôleges ellenelektród mellett, külsô áramforrást alkalmazva). Azt az elektródot, ahol redukció zajlik, katódnak, az oxidáció helyét pedig anódnak nevezzük Faraday nyomán. Ezzel összhangban katódos áramról akkor beszélünk, ha elektronok lépnek át az elektródról az oldatba, annak valamelyik komponensét redukálva. Fordított irányú elektronátlépéskor az oldat alkotórésze oxidálódik, ilyenkor anódos áramról beszélünk. Vegyük észre, hogy az elektrolizáló cellában a katód az anódhoz képest negatív, míg a galváncellában fordított a helyzet. Katódos áram és katódos reakció tehát a (referenciához képest) pozitívabb vagy a negatívabb elektródon egyaránt végbemehet.
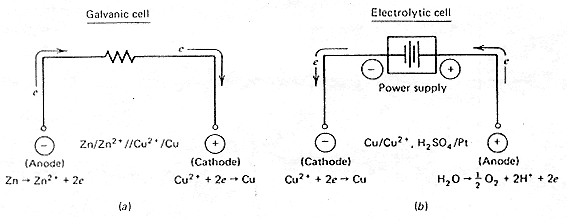
2. ábra