1. (15 pont) Írjuk fel a következõ szerkezeteket:
a) N,N-dimetil-glicin (pH=7-nél)

1. (15 pont) Írjuk fel a következõ szerkezeteket:
a) N,N-dimetil-glicin (pH=7-nél)

b) a vajsav trigliceridje (glicerin-tributanoát)

c) a citozin enol tautomerje

d) triptofánil-aszparaginsav (pH=7-nél)

e) dezoxi-timidin-5'-foszfát

2. (12 pont) Adjuk meg a következõ molekulák vizes
oldatban elõforduló domináns szerkezetét pH=1,
7 és 12 esetén.
a) glutamin

b) lizin

3. (16 pont) Az aminosavak oldalláncain illusztráljuk
pH=7-nél a fehérjék harmadlagos szerkezetében
közremûködõ kölcsönhatásokat.
Például:
diszulfid-kapcsolás Cys --Cys : )-CH2-S-S-CH2-(
(több lehetséges válasz létezik)
a) töltés-töltés (Coulomb-) vonzás

b) töltés-dipól H-kötés

c) dipól-dipól H-kötés

d) apoláros (hidrofób) kölcsönhatás

4. (12 pont) Vizsgáljuk meg, és állítsuk
növekvõ sorrendbe a következõ aminosavak (tipikus
alfa-, béta- és gamma-aminosavak) pKa
értékeit.
pKa értékek:
glicin H2N-CH2-COOH 2.34 9.60
béta-alanin H2N-CH2-CH2-COOH
3.55 10.24
4-amino-vajsav H2N-CH2-CH2-CH2-COOH
4.03 10.56
(3 pont) A természetes alfa-aminosavak savasabbak vagy kevésbé
savasak a béta- vagy gamma-aminosavaknál?
Savasabbak
(3 pont) A természetes alfa-aminosavak aminocsoportja
bázikusabb vagy kevésbé bázikus a béta-
vagy gamma-aminosavak aminocsoportjánál?
Kevésbé bázikus
(6 pont) Mi a különbség oka?
A karbonilcsoporthoz közeli NH3+ elektronvonzó,
megkönnyíti a proton távozását a COOH-ról.
Minél közelebb van az aminocsoport, annál erõsebb
a sav.
Az ammóniumionhoz közeli COO- -csoport elektronvonzó,
megkönnyíti a proton távozását az NH3+-ról.
Minél közelebb van a COO- -csoport, annál
savasabb (gyengébb bázis) az NH3+.
5a. (5 pont) Mutassuk meg, miért olyan bázikus az arginin,
rajzoljuk fel a guanidin oldallánc protonált formájának
rezonancia formáit.
| a legbázikusabb hely | 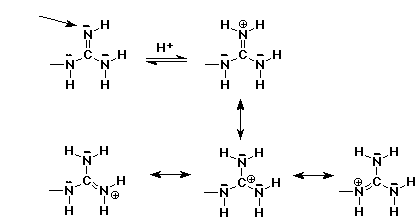 |
5b. (2 pont) Melyik N a legbázikusabb a guaninban?

6. (18 pont) Egy DNS információ hordozó szálja
a következõ bázisszekvenciát tartalmazza (5'-->
3' irányban).
C G T T A C C T A C A A G C C T G T
a) (3 pont) Adjuk meg a megfelelõ komplementer szálat.
G C A A T G G A T G T T C G G A C A (3'--> 5' irány)
b) (3 pont) Adjuk meg azt az m-RNS szekvenciát, amelyre lefordítódna.
C G U U A C C U A C A A G C C U G U ( 5' --> 3' irány)
c) (6 pont) Adjuk meg a használt t-RNS-ek antikodonjait és
a megfelelô aminosavakat, ha az m-RNS fehérjeszintézisben
vesz részt.
antikodonok (3'--> 5' irány)
GCA - Arg
AUG - Tyr
GUA - Leu
GUU - Gln
CGG - Ala
ACA - Cys
d) (6 pont) Az eredeti DNS-szekvenciában 6 db C-bázis
található (számozzuk 1-6-ig). Egy C --> T mutáció
csak két esetben eredményezne drasztikus változást,
egyben kisebb változást és háromban nem okozna
eltérést. Melyek ezek a C-k?
C1 G T T A C2 C3 T A C4 A A
G C5 C6 T G T
i) drasztikus
C1 : CGU –> UGU, Arg –> Cys
C4 : CAA –> UAA, Gln –> Stop
ii) kis változás
C5 : GCC –> GUC, Ala –> Val
iii) nincs eltérés
C2 : UAC –> UAU mindkettõ Tyr
C3 : CUA –> UUA mindkettõ Leu
C6 : GCC –> GCU mindkettõ Ala
7. (20 pont) Találjuk ki a következõket a PheLeu
dipeptidrõl:
a) (3 pont) Mi a DNS-kódja?
Egyik lehetséges: UUUUUA.
Phe lehet UUU vagy UUC
Leu lehet még UUA vagy UUG vagy CUX (X bármi lehet)
b) (3 pont) Mennyi az izoelektromos pontja?
5.75 (a 9.13 és a 2.36 átlaga)
Az N-terminális hasonló kell legyen a Phe-hoz (pKa
=9.13), a C-terminális pedig a Leu-hoz (pKa =2.36).
c) (8 pont) Milyen termék(ek) keletkezik/keletkeznek, ha
i) cc. HCl-val forraljuk
Phe + Leu
ii) Edman-reagenssel kezeljük
a Phe + Leu fenil-tiohidantoin származéka
iiii) tripszinnel kezeljük
nem reagál
iv) kimotrpszinnel kezeljük
Phe + Leu
d) (6 pont) Tervezzünk szintézist az elõállítására,
BOC védõcsoportot és DCC kapcsolószert használva.
Phe --(BOC)--> BOC-Phe --(DCC)--> --(Leu)--> BOC-Phe-Leu --(TFA)-->
Phe-Leu