

Gouy, Debye–Hückel és Fick. Hogyan értsünk meg differenciálegyenleteket anélkül, hogy megoldanánk õket?
Amikor a töltött részecskék, például az ionok vagy a kolloid részecskék viselkedését próbáljuk megmagyarázni, elõjönnek a Coulomb-kölcsönhatások és végül a Poisson–Boltzmann-differenciálegyenletnél kötünk ki. Az egyenlet megoldása – bár a matematikával felvértezett hallgatókat nem hozza zavarba – igen hosszadalmas, és a matematikai mûveletek részletezése elvonhatja a figyelmet arról, amirõl az egyenlet szól. Ebben a rövid írásban egyszerû, intuitív módszert mutatunk be, amely azt illusztrálja, hogy a differenciálegyenleteket néha anélkül is értelmezhetjük, hogy megoldanánk õket.
Amikor a körülöttünk levõ fizikai világot kvantitatív, ellenõrizhetõ eszközökkel igyekszünk megérteni, rendszerint több fázison haladunk át. Elõször a problémát – fogalmilag – a leglényegesebb elemeire csupaszítjuk le, azután formába öntjük, majd megoldjuk. A fogalmi és a matematikai megfogalmazásnál általában leegyszerûsítjük a problémát (töröljük a kevésbé fontos részleteket), hogy a leglényegesebb részeket valamilyen szimbolikus rendszer – most például a matematika, pontosabban egy differenciálegyenlet – segítségével fejezhessük ki. A megoldás az egyenletek kezelése annak érdekében, hogy a paraméterekre explicit kifejezéseket kapjunk. Amikor kvantitatíve igazolható eredményekre törekszünk, nem hagyhatjuk ki a formulák megfogalmazásának fázisait. Ez az írás csak a megoldás fázisát tárgyalja, s elkerüli az explicit matematikai megoldások keresésével járó hosszadalmas munkát.
Elõször az elektromos kettõsréteg problémáját
írjuk le, majd levezetjük a megfelelõ matematikai összefüggést.
A problémát leíró differenciálegyenletet
azonban nem oldjuk meg, hanem néhány dimenziómentes
mennyiségbõl következtetünk az egyenletben rejlõ
legfontosabb információkra. Ezután a Debye–Hückel-egyenletet
vizsgáljuk meg, és megmutatjuk, hogy igen hasonló
módon kezelhetõ, mert matematikailag lényegében
az elõzõvel azonos probléma. A módszert a Fick-egyenletre
is alkalmazzuk.
Az elektromos kettõsréteg
A századforduló táján Georges Gouy, a kor egyik nagy, de többé-kevésbé elfeledett tudósa, az elektrokémikusok gyakori foglalatosságát ûzve a molekulák és az ionok adszorpcióját vizsgálta a higanylektród és a vizes oldat közötti határfelületen. Molekulák esetében a probléma viszonylag egyszerû, mert a molekulák a higanyelektróddal mindig rövid távú kölcsönhatásokba bocsátkoznak (például a kovalens vagy hidrofób kölcsönhatások esetén), vagy legfeljebb a molekulák dipólus momentumainak és polarizálhatóságainak függvényei. A dipól kölcsönhatások erõssége meredeken csökken a távolság függvényében, amint a távolság naggyá válik a dipólus töltésszétválásához képest. A polarizálhatóság hatása még lokálisabb. A fém–oldat határfelületen lejátszódó molekuláris adszorpció ezért az adszorbátum és a fém közötti közvetlen érintkezés feltevésével írható le. Ez az elképzelés megfelelt az akkoriban elfogadott, Helmholtz-féle higany–víz határfelület modellnek, amely szerint a határfelületen egyetlen réteg adszorbeált molekula vagy ion van.
Az ionok azonban hosszú távú Coulomb-kölcsönhatásokat hoznak létre az elektromos határfelülettel, s emiatt nincs szükség érintkezésre. Ezért az ionok az elektrosztatikus vonzásra és taszításra már akkor is reagálhatnak, ha az elektród szomszédságában vannak, s ebben az esetben mind az elektrosztatikus vonzásnak vagy taszításnak, mind a hõmozgásnak ki vannak téve. A feladat tehát az elektrosztatikus kölcsönhatás és a hõmozgás közös hatásának leírása. Ezt oldotta meg Gouy. A fémen levõ elektromos töltést és a szomszédos oldatban levõ ionos töltést elektromos kettõsrétegnek nevezik. Ebben a tartományban nincs lokális elektroneutralitás, ezért tértöltési rétegként is említik.
Az alábbiakban Gouy módszerét fogjuk követni
számos egyszerû esetben; elõször egyetlen z,z-elektrolitot
tekintünk – ilyen például a NaCl vagy a MgSO4 –
és síkelektródot vizsgálunk, tehát csak
egyetlen térbeli paramétert, a fém–oldat határfelülettõl
mért x távolságot kell figyelembe vennünk.
A Poisson–Boltzmann-differenciálegyenlet
Az elektrosztatika és a hõmozgás együttes
hatását leíró elsõdleges összefüggés
a Boltzmann-egyenlet. Ezzel a formulával adjuk meg a kationok és
az anionok lokális koncentrációját a lokális
y
potenciál függvényében:
 |
(1) |
 |
(2) |
ahol c+ és c– a lokális kation- és anionkoncentráció a távolság függvényében, és c* a só oldatbeli koncentrációja a határfelülettõl elegendõen nagy távolságban, ahol a határfelület hatása már nem érzékelhetõ, tehát y =0. Az F, R és T paraméter a szokásos Faraday-állandó, gázállandó és abszolút hõmérséklet. Az exponenciálisokban az elõjelek arra utalnak, hogy a pozitív y potenciál a kationokat taszítja, az anionokat vonzza, míg a negatív potenciál ellentétes hatású. NaCl esetében |z|=1, mert mind a Na+, mind a Cl– egy vegyértékû ion; MgSO4 esetében |z|=2.
A másik szükséges összefüggés, a
Poisson-egyenlet, a potenciál és a lokális töltéssûrûség
kapcsolatát írja le. Síkbeli geometriánk esetében:
 |
(3) |
ahol r a lokális töltéssûrûség
(egységnyi térfogatra számítva), és
e
az oldat dielektromos permittivitása (vagy dielektromos "állandója").
A határfelülettõl távol mind y
, mind r zérus, de az elektród
közelében kation- vagy aniontöbblet alakulhat ki. Egyetlen
z,z-elektrolit
esetében a lokális töltéssûrûség:
| (4) |
ahol a (coulomb/mól-ban kifejezett) Faraday-állandó a kémiai számsûrûséget (vagyis a mól/térfogatban kifejezett koncentrációt) elektromos töltéssûrûséggé alakítja át (az utóbbi dimenziója coulomb/térfogat).
Ez a négy összefüggés adja együtt a Poisson–Boltzmann-egyenletet:
 |
(5) |
Az eredmény igen bonyolultnak tûnik, de jelentõsen
egyszerûsíthetõ a dimenziómentes y=|z|Fy
/RT paraméter bevezetésével, ami az (5) egyenletet
a következõ alakra hozza:
 |
(6) |
Információszerzés az egyenlet megoldása nélkül
Ahelyett, hogy megoldanánk, nézzük meg alaposan az egyenletet! Mivel y dimenziómentes, a (6) egyenlet bal oldalának 1/x2 a dimenziója, ahol x távolság. A (6) egyenlet jobb oldalának zárójeles kifejezése dimenziómentes, ezért z2F2c*/eRT-nek is 1/x2 a dimenziója (vagyis reciprok távolságnégyzet). Továbbá a z2F2c*/eRT az egyetlen olyan változó a (6) egyenletben, amely függ a kísérleti körülményektõl. Ezért eRT/z2F2c* négyzetgyökének a probléma karakterisztikus távolságának kell lennie. Ezt a távolságparamétert, amely az elektród melletti tértöltési réteg karakterisztikus távolságát reprezentája, Gouy [1,2] a-val vagy a-val jelölte. Ma általában a reciprokát (k=1/a) használják, amelyet Debye és Hückel vezetett be [3].
Bevezethetünk azonban egy másik dimenziómentes paramétert is: x=x/xkar=xÖ(eRT/z2F2c*), s így a (6) egyenlet a következõ alakot ölti: d2y/dx2=e–y–e+y. Nyilvánvaló, hogy a dimenziómentes y potenciál viselkedését teljesen meg kell határoznia a x=x/xkar értéknek, tehát a karakterisztikus távolság, xkar szerint szerint skálázott x értéknek.
Érdemes most visszatekinteni a fenti levezetésre, hogy
észrevegyük: a felhasznált egyenletek érzéketlenek
a sók kémiai jellegére, és csak az ionok vegyértékeit
tartalmazzák. Ezért a meggondolás könnyen kiterjeszthetõ
a z,z-elektrolitok keverékeire – ilyen például
a KCl+NaClO4+LiH2PO4 vagy a MgSO4+BeSO4–,
ha a (4) egyenletet a
| (4') |
kifejezéssel helyettesítjük. Ekkor az (5) és
(6) egyenlet a következõképpen alakul:
 |
(5') |
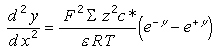 |
(6') |
A tértöltési réteg a karakterisztikus
vastagsága:
 |
(7) |
reciproka:
 |
(8) |
Figyeljük meg, hogy a c* sókoncentráció ezekben a kifejezésekben a Sz2c* kifejezés négyzetgyökében jelenik meg. Gouy [2] a leggyakoribb aszimmetrikus sók, például a Li2SO4, a CaCl2, a Na3PO4 és az Al(NO3)3 esetében is elemezte a megfelelõ eredményeket, Levine és Jones [4] pedig egy és két vegyértékû ionok tetszõleges keverékeire is kiterjesztette a számítást. A meghatározó tulajdonság minden esetben Szi2ci*, ahol az összegzés az összes i ionra kiterjed. Egyetlen 1,1-elektrolit esetében ez az összeg a sókoncentráció kétszerese, ezért célszerûbb a felét, 1/2Szi2ci*-t tekinteni; ezt a paraméterkombinációt Lewis és Randall [5] ionerõsségnek nevezte el. A tértöltési réteg a=1/k karakterisztikus vastagsága vizes oldatban, szobahõmérsékleten 10, 3, 1 és 0,3 nm, ha az ionerõsség rendre 0,001, 0,01, 0,1 és 1 M.
A tértöltési réteg teljes leírásához
természetesen meg kell oldani a fenti egyenleteket. Most csak annyit
jegyzünk meg, hogy gyakran kapunk jó közelítést,
ha feltesszük, hogy a határfelülettõl távolodva
a potenciál exponenciálisan csökken, tehát
| (9) |
ahol yo a-tól (vagy
k-tól)
és a fémen kialakuló felületi töltéssûrûségtõl
függ [6]. A jelenlegi tárgyalás szempontjából
igen fontos, hogy mind yo,
mind a=1/k az ionerõsség
növekedésével csökken. A Gouy-modell érvényességét
a legközvetlenebb módon Israelachvili és Adams elegáns
kísérletei [7] igazolták.
Alkalmazások
Kolloid szuszpenziók stabilitása
Nemcsak fémek, hanem kolloidok, például AgCl-részecskék körül is kialakulnak elektromos kettõsrétegek. Ekkor a felületi töltéssûrûséget a többletionok (akár Ag+-, akár Cl–-ionok) hozzák létre a fémek elektronjai helyett, de minden más ugyanúgy érvényes, mint az elõbb. Tegyük fel, hogy az ezüst-nitrát oldatba adagolt nátrium-klorid oldattal ezüst-klorid csapadékot hozunk létre. Kezdetben az oldat olyan többlet ezüstionokat tartalmaz, amelyek még nem csapódtak ki. A többlet ezüstionok némelyike a megfelelõ rácshelyekre épülhet be az ezüst-klorid részecskéken. Ezek az ezüst-klorid részecskék pozitív töltésre, s így pozitív yo-ra tesznek szert, ezért olyan anionokkal, ebben az esetben nitrátionokkal veszik magukat körül, amelyek nem épülnek be a kristályba. Az összes AgCl-részecske körül tértöltési réteg alakul ki. Mivel ezek a rétegek taszítják egymást, a részecskék nem közelíthetik meg tetszõlgesen egymást, tehát nem állhatnak össze nagyobb képzõdményekké. Olyan kicsik maradnak, hogy sokszor a szûrõn is átszaladnak. A kölcsönösen taszító elektromos kettõsréteggel körülvett, kis, töltött részecskék szuszpenziója kolloid szuszpenziót képez. Többlet NaCl hatására a tértöltési rétegek ellentétes töltésûvé válhatnak: többlet Cl– lesz a felszínükön, és azok a kationok hozzák létre a tértöltési rétegek, amelyek nem épülnek be a kristályrácsba (ezúttal a nátriumionok).
A szuszpenziót úgy vihetjük oldatba, ha egy másik,
csapadékot
nem képezõ elektrolit adagolásával csökkentjük
a yo potenciált és
az a=1/k rétegvastagságot.
Ez az eljárás nem intuitív eredmény, hanem
az elméletbõl következik, és kísérletekkel
is alaposan igazolták. A töltött kolloid szuszpenziók
stabilitására vonatkozó Gyerjagin–Landau–Verwey–Overbeek-modell
[8,9] valójában a Gouy-elméleten alapszik.
Ionos kölcsönhatások
Az ionkristályokban, például a szilárd nátrium-kloridban, azonos számú kation és anion van, mégis mindegyiket elsõsorban a másik fajtához tartozó ionok veszik körül, ezért elektrosztatikus vonzás hat rájuk. A szilárd nátrium-kloridban például a Na+- és a Cl–-ionok körülbelül 1,75-ször nagyobb elektrosztatikus vonzást érzékelnek, mint egyetlen ellenion jelenlétében észlelnének, ha ez az ion a lehetõ legjobban megközelítené õket [10].
Az elektrolitoldatban az ionok között természetesen
vízmolekulák is vannak, és az ionok nem szabályos
rácshelyeken ülnek, hanem hõmozgást végeznek.
A vonzó ionos kölcsönhatás azonban megmarad: a
kationok az anionok közelében fordulnak elõ a legnagyobb
valószínûséggel (és fordítva).
Debye és Hückel [3] ennek a problémának a leírását
matematikailag kezelhetõ problémára egyszerûsítette:
az izolált iont olyan hipotetikus, egyenletesen szétkent
töltéstengerbe, ionfelhõbe helyezte, amelynek
teljes töltése éppen ellentétes a kiválasztott
ionéval. Az eredményül kapott Poisson–Boltzmann-egyenlet
nagyon hasonlít Gouy egyenletéhez azzal a kivétellel,
hogy a központi ion körül gömbi geometriával
számol. A levezetés ugyanaz, mint az (1)–(6) egyenletek esetében,
de a Poisson-egyenletet most gömbi koordinátákban írjuk
fel:
 |
(10) |
Egyetlen z,z-elektrolitra a következõ eredmény
adódik:
 |
(11) |
ahol r a központi iontól mért radiális távolság;
a dimenziómentes y paraméter definíciója
ugyanaz, mint az elõbb, vagyis y=|z|Fy
/RT. Figyeljük meg, hogy az (11) egyenlet jobb oldala hasonlít
a (6) egyenletéhez, és bal oldalának dimenziója
ismét reciprok távolságnégyzet, 1/r2.
Tehát most is az elõbbi gondolatmenetet alkalmazhatjuk: a
(7) és (8) egyenlettel kifejezett a=1/k
távolság az egyes ionok körüli tértöltési
réteg sugarát határozza meg, és az 1/2Szi2ci*
ionerõsség ismét a koncentráció hatását
méri. Ez az oka annak, hogy a Debye–Hückel-elméletbõl
következõ aktivitási koefficienseket az ionerõsség
négyzetgyökének függvényében ábrázolják,
és a y potenciált közelítõleg
a yoexp[–r/a]=yoexp[–kr]
kifejezés adja meg.
További eredmények, következmények
A fenti eljárás segítségével – pusztán a dimenziókat vizsgálva – a Poisson–Boltzmann-differenciálegyenletbõl megkaphatjuk a karakterisztikus a vagy k paramétert, amely leírja a töltött elektród, a töltött mikroszkopikus részecske, például kolloid vagy ion körüli tértöltési réteg kiterjedését. A kolloid részecskék akkorák, hogy (átlagos) görbületi sugaruk rendszerint sokkal nagyobb, mint a=1/k; ebben az esetben a görbület elhanyagolható, és a Poisson-egyenlet síkgeometriára vonatkozó alakja használható. Ionok esetében ez a közelítés nyilvánvalóan nem használható; a Poisson-egyenlet gömbi alakját kell alkalmazni. Az a=1/k mennyiség azonban mindkét esetben megadja a tértöltési réteg karakterisztikus vastagságát, vagyis annak a távolságnak a nagyságrendjét, amelyen az elektroneutralitás nem áll fenn.
Általában a kolloidok kicsapódásának és az elektrolitoldatok aktivitásának példáján vezetik be a hallgatóknak a tértöltési réteg fogalmát: a két rokon problémában ugyanaz az egyenlet és ugyanaz a dimenziómentes paraméter játszik hasonló szerepet. Ha például membránban oldódó ionok vagy ionhordozó komplexek vándorolnak lipid kettõsrétegen, a Poisson–Boltzmann-egyenlet mellett a Nernst–Planck-egyenletet is figyelembe kell venni a diffúzió és a vándorlás leírására, s nemcsak a membránok szomszédságában, hanem a belsejükben is kialakulhatnak tértöltési rétegek [11].
Amikor arra törekszünk, hogy a matematikai egyenletek megoldásait zárt alakban állítsuk elõ, az egyenletek tartalmára nem mindig jut kellõ figyelem. Sok vegyészhallgató nem elég jártas ezeknek az egyenleteknek megoldásában; de még ha gyakorlott is, a kémiának nem a matematikai megoldás részleteire, hanem az egyenletek fizikai és kémiai következményeire kell figyelnie. Kedvezõ esetben, mint a mostani példában, a legfontosabb információkat az egyenletek megoldása nélkül is megszerezhetjük az egyenletekbõl. Az explicit megoldások gyakran igen bonyolultak, ezért nehezen szemléltethetõk; az itt bemutatott módszerrel ez a nehézség is elkerülhetõ. A karakterisztikus paraméterkombinációra koncentrálva azonnal a probléma lényegét ragadjuk meg.
Furcsa módon a legújabb eszközök, például a szimbolikus megoldásokat szolgáltató Maple vagy Mathematica programok általában nem sokat segítenek. Még ha megtalálják is a megoldást (ami a Gouy-modell esetében sikerül, a Debye–Hückel-egyenletnél már nem), az eredmény olyan bonyolult, hogy alig értelmezhetõ.
Az itt bemutatott gondolatmenet természetesen nemcsak a Poisson–Boltzmann-egyenletre korlátozódik. Például a diffúziós tömegtranszportot leíró Fick-törvény legegyszerûbb, egydimenziós alakja
1. Gouy, G. C. R. Acad. Sci. 1909, 149,
654.
2. Gouy, G. J. Phys. (Series 4) 1910, 9, 457.
3. Debye, P.; Hückel, E. Phys Z. 1923, 24,
185.
4. Levine, S.; Jones, J. E. Kolloid Z. 1969,
230, 306.
5. Lewis, G. N.; Randall, M. J. Am. Chem. Soc. 1921, 43,
1112.
6. de Levie, R. J. Electroanal. Chem. 1990, 278,
17.
7. Israelachvili, J. N.; Adams, G. E. J. Chem. Soc. Faraday Trans.
1, 1978, 74, 975.
8. Gyerjagin, B.; Landau, L. Acta Physicochim. URSS 1941,
14,
633.
9. Verwey, J. W.; Overbeek, J. T. G.: Theory of the Stability of
Lyophobic Colloids, Elsevier: Amsterdam, 1948.
10. Madelung, E. Z. Phys. 1918, 19, 524.
11. de Levie, R.; Moreira, H. J. Membrane Biol. 1972,
9,
241.
12. Fick, A. Ann. Phys. 1855, 170, 59.
| Vissza | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |