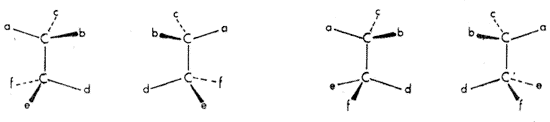
5. ábra
Kajtár Márton
"Kémia a térben"
Van't Hoff emlékezetére
Emlékezzünk vissza van't Hoff rövid dolgozatának hosszú címére. Van abban még egy "megjegyzés a szerves vegyületek optikai forgatóképessége és kémiai konstitúciója közötti összefüggésrôl". (A "konstitúció" alatt itt van't Hoff az általa bevezetett, a "térre kiterjesztett" konstitúciót, vagyis a térszerkezetet érti!) Valóban, a tejsavak esetében tapasztalt és a hasonló izomériajelenségek mindig kapcsolatban vannak az optikai aktivitással. A tejsav két azonos konstitúciójú izomerje optikailag aktív. Hogy is jön létre az optikai forgatás? Fresnel elmélete szerint a síkban polarizált fény két ellentétes irányába cirkulárisan polarizált komponensbôl tevôdik össze. Optikailag aktív közegben az egyik cirkuláris komponens lassabban halad, mint a másik, ezért aztán amikor kilépnek a közegbôl, eltolódott fázisban összegezôdnek újra, s ez a polarizáció síkjának elfordulásában nyilvánul meg. A lényeg tehát az, hogy az optikailag aktív anyag molekulái különbözô mértékû kölcsönhatásba lépnek a jobbra és a balra cirkuláris fénysugárral. A cirkulárisan polározott fény úgy jellemezhetô, hogy a fénysugár mentén az elektromágneses teret leíró elektromos és mágneses vektorok végpontjai egy jobb vagy bal menetû csavarvonalon helyezkednek el. Nincs szükség itt arra, hogy ezt a meglehetôsen bonyolult kérdést részletesebben fejtegessük, elég annyi, hogy a síkban polározott fény két cirkuláris komponense olyan viszonyban van egymással, mint egy jobb menetû csavar a bal menetûhöz. Márpedig ez enantiomer viszony; a csavarvonal ugyanis királis alakzat, a jobb csavar a bal csavarnak tükörképe, de a kettô nem azonos. Kézelfekvô a gondolat, hogy egy királis molekula a két enantiomer, királis fénysugárral különbözô kölcsönhatásba lép: egyiket jobban lelassítja, mint a másikát. Ugyanakkor a királis molekula enantiomerje éppen ellentétes hatást gyakorol a két fénysugárra: azt lassítja jobban, amelyet az elôbbi könnyebben átengedett. Ezért aztán a két enantiomer molekula ellentétes irányba forgatja el a polarizációs síkot. Akárhogy is van a dolog, érthetô, hogy a királis szerkezetû tárgy különbséget tud tenni két királis dolog között, a tükörszimmetrikus (akirális) viszont nem. Egy szabályos, téglalap alakú dobozban egyformán elfér egy jobb kezes meg egy bal kezes kesztyû, de próbálja meg valaki fordítva felhúzni a kezére a kesztyûit. A királis kéz különbséget tesz a királis kesztyûk között, az akirális doboz nem. Ha nem is ismerjük a fény és a molekulák kölcsönhatásának fizikai mechanizmusát (a múlt században még nem is merték), a viszonyt akkor is világosan felismerhetjük: az optikailag aktív anyag molekuláinak királisaknak kell lenniük, az inaktívnak meg akirálisaknak. Ezt az összefüggést a borkôsavak. optikai aktivitásával kapcsolatos vizsgálatai alapján Pasteur már 1849-ben felismerte, csak nem tudta, milyen térszerkezeti elv hozza létre egyes molekulákban a kiralitást. Ha kérdés formájában is, mégis megkockáztatta a feltevést: "Talán egy jobb menetû csavarvonal mentén helyezkednek el a jobbra forgató sav atomjai, vagy tán egy szabálytalan tetraéder csúcsain?" Van't Hoff tetraédermodellje pontosan megadja a kiralitás molekulaszerkezeti feltételeit. Mindazok a vegyületek, melyek molekulái a tetraédermodell szerint királisak, optikailag aktívnak bizonyultak, az akirális molekulájúak meg inaktívnak. Sok évtized rengeteg vizsgálata egyetlen esetben sem cáfolta meg a tetraéderelmélet következtetéseit ezen a téren.
A tetraéderelmélet tehát a tejsav és a hozzá hasonló vegyületek izomériáját és optikai aktivitását egyaránt értelmezni tudta. Van't Hoff azonban nem elégedett meg ennyivel, hanem következetesen végiggondolta a tetraéderelv követelményeit bonyolultabb konstitúciójú mole kulákra is. A tetraédermodell szerint az egyszeres kötéssel kapcsolódó szénatomok "tetraéderei" egy-egy csúcsukon át kapcsolódnak, a kétszeres kötésûeké egy-egy élükön át, a háromszoros kötésû szénatomok tetraéderei pedig egy-egy lapjukkal illeszkednek egymáshoz. A megfelelô szénatomok mindig a tetraéder középpontjában képzelendôk el. A három lehetôség van't Hoff eredeti ábráin is szerepel (3. ábra). A csúcsokon át érintkezô két tetraéder relatív helyzete van't Hoff szerint nincs rögzítve, vagyis az egyszeres kötés körül szabadon elforoghat a két szénatom a hozzájuk kapcsolódó három-három ligandummal együtt. A tetraéderelv a nem azonos szénatomokhoz kapcsolódó atomok relatív helyzetét nem rögzíti. Mai sztereokémiai ismereteink szerint a nem azonos atomokhoz kapcsolódó atomok relatív térbeli helyzete is többé-kevésbé rögzített ugyan, de ez nem a tetraéderelv következménye. A nem azonos atomokhoz kapcsolódó atomok különbözô relatív helyzetére visszavezethetô izomériajelenséget van't Hoff idejében még senki nem észlelt, a "szabad rotáció", az egyszeres kötések körüli szabad forgás feltételezése tehát az izomerek számából következik. (Különben vagy nagyon sok izomer lehetôségét kellene feltételezni ott is, ahol ilyent soha nem tapasztaltak, vagy önényesen rögzíteni kellene a tetraédereket valamilyen helyzetben, amire szintén nincs semmi tapasztalati ténybôl következô alap.) Ebbôl is az tûnik ki, hogy van't Hoff mindig tartózkodóan bánt a fantáziájával; modellje csak olyan elemeket tartalmaz, melyekre a tapasztalt izomériajelenségek értelmezéséhez feltétlenül szükség van. Minden további részletkérdés tudományosan megalapozatlan fantázia lett volna.
Van't Hoff levezette a lehetséges térszerkezeteket olyan konstitúciókból is, melyekben nemcsak egy, hanem két vagy több olyan szénatom is elôfordul, mely mind a négy vegyértékével más-más ligandumhoz kapcsolódik. Az ilyen aszimmetrikusan szubsztituált szénatomot van't Hoff "aszimmetriacentrum"-nak nevezte, ma inkább kiralitáscentrumnak nevezzük. Minden kiralitáscentrum körül kétféle konfiguráció lehetséges; egy molekulaépítményen belül minden újabb kiralitáscentrum megkétszerezi a sztereoizomer lehetôségek számát (Az izomériának azt az esetét, amikor két molekula konstitúciója azonos, csak a térbeli, háromdimenziós szerkezetükben különböznek, sztereoizomériának, térizomériának nevezzük. Az enantiomerek sztereoizomerek.) Két kiralitáscentrum négy sztereoizomer lehetôségéhez vezet (5. ábra).
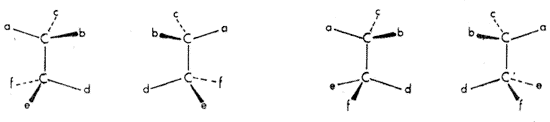
5. ábra
Két kiralitáscentrum jelentése egy molekulában
egy általán nem ritkaság. Nagyon sok fontos olyan
vegyületet ismerünk, melyben 5-6, sôt ennél is több
kiralitáscentrum található. A megkétszerezôdés
szabálya alapján kiszámíthatjuk, hogy ilyen
vegyületekbôl 2n számú sztereoizomer
lehetséges (ahol n a kiralitáscentrumok száma). Ez
két érdekes tényre is felhívja a figyelmünket
Ha pl. a természetben találunk egy vegyületet, a szokásos
kémiai módszerekkel meghatározzuk a konstitúcióját,
és azt vesszük észre, hogy a konstitúció
szerint a molekulában négy olyan szénatom is van,
melyhez négy különbözô atom, illetve
csoport kapcsolódik, akkor tudomásul kell vennünk, hogy
még nagyon távol állunk a molekula szerkezetének
ismeretétôl. A molekula térszerkezetére ugyanis
16 variációs lehetôség adódik, s amíg
nem döntjük el, hogy a vizsgált vegyület térszerkezete
a 16 lehetôség közül melyik, nem várhatjuk,
hogy értelmezni tudjuk sajátságait. Bizony, a kémiai
szerkezetvizsgálatnak sokszor a térszerkezet meghatározása
a legnehezebb részletfeladata. – Hasonló nehézségekkel
találjuk magunkat szemben, ha egy olyan vegyületet akarunk
elôállítani, amelynek 16 sztereoizomer módosulata
lehetséges. Ekkor bizony nem érhetjük be azzal, hogy
elvégezzük a szokásos átalakításokat,
melyek egy-egy konstitúciós részlet kialakítására
vannak kidolgozva, hanem ügyelni kell arra is, hogy az egyes kiralitáscentrumok
körül, melyeket a molekulában kialakítunk, éppen
az a konfiguráció valósuljon meg, amelyik a célvegyületben
is megtalálható. Vagyis: szintézisünk terméke,
a 16 alapjában véve azonos módszerekkel elôállítható
sztereoizomer közül, csak az az egy legyen, amelyiket szintetizálni
akarunk. A szintetikus munkában is rendszerint a térszerkezet
kialakítása jelenti a legnagyobb nehézségeket.
 |
 |
| 6/a ábra | 6/b ábra |
A térszerkezeti lehetôségek ismerete nélkül tehát sem a szerkezetvizsgálatban, sem a szintézisben nem lettek volna elérhetôk azok a nagyszerû eredmények, melyekkel a szerves kémia joggal büszkélkedik. Éppen a természetben elôforduló legérdekesebb és biológiai hatás szempontjából igen jelentôs vegyületek túlnyomó többsége több kiralitáscentrumot is tartalmaz, tehát sok sztereoizomer térszerkezetre van lehetôség. Ezek közül a természetben rendszerint csak egy valósul meg. A cukrok leggyakoribb típusának (az ún. hexózoknak) pl. olyan a konstitúciója, hogy (a gyûrûs formában) öt kiralitáscentrum található benne (6/a ábra). A 32 lehetséges sztereoizomer közül a természetben csak ritkán fordul elô négynél több. A koleszterinben 7 kiralitáscentrum van (6/b ábra), térszerkezetére tehát elvileg 128 lehetôség adódik. óriási munka volt, míg megállapították, hogy ez a minden élô sejtben megtalálható, fontos molekula melyik a 128 lehetôség közül.
A tetraéderelmélet által megjósolt izomérialehetôségek
máig is mind érvényeseknek bizonyultak, igazolván;
hogy az elmélet egyszerû kiindulópontja mélyen
a valóságban gyökeredzik. Ne menjünk el anélkül
e nagyszerû eredmény mellett, hogy ne adóznánk
kellô tisztelettel az egyszerû és világos alapgondolat
és következetes ás logikus kifejtés szellemi
teljesítménye elôtt. A tetraéderelven alapult
a sztereokémia elsô fél évszázadának
minden sikere. Sok ezer, köztük sok nagyon bonyolult szénvegyület
térszerkezetét derítették fel ezekben az évtizedekben
a tetraéderelv és az izomériaelv alapján, valójában
anélkül, hogy a molekulák térszerkezetével
közvetlenebb kapcsolatban levô; bármilyen fizikai sajátságot
vizsgálhattak volna. A jelen század elsô felében
megindult röntgendiffrakciós vizsgálatok aztán
kísérletileg is igazolták a tetraéderelv érvényességét.
Azóta sok más fizikai vizsgálati módszert –
elektrondiffrakciót, infravörös és mágneses
magrezonancia-spektroszkópiát, az egyetlen hullámhosszon
megmért optikai forgatóképességnél sokkal
több és mélyebb információt nyújtó
optikai rotációs diszperzió és az ún.
cirkuláris dikroizmus meghatározásán alapuló
spektroszkópiai módszert – alkalmaznak a molekulaszerkezet
finomabb részletkérdéseinek vizsgálatára.
A kvantumelmélet fejlôdése lehetôvé
tette, hogy az atommagokból és elektronokból felépülô
molekuláris rendszerek energiaviszonyait elméletileg kiszámítsák;
így a lehetséges térszerkezetek stabilitási
viszonyairól is kvantitatív képet nyertünk. A
ma lehetséges legfontosabb, ún. ab initio kvantumkémiai
számítások eredményei is mindenben alátámasztják
az egyszerû tetraéderelv alapvetô következtetéseit.
Kétségtelen, hogy a tetraéderelmélet magját
képezô gondolat elég kézenfekvônek tetszik.
Ha egy atomot a térben négy másik. atom vesz körül
úgy, hogy a teret minél egyenletesebben kitöltsék,
a tetraéderes
elrendezôdés a legtermészetesebb. Erre valóban
gondoltak már mások is van't Hoff elôtt. Az
ô érdeme az elv határozott megfogalmazása s
az a kristálytiszta logika, mellyel az egyszerû elv következményeit
levonva nemcsak az akkor ismert valamennyi izomériaeset értelmezését
adta meg, hanem sok új lehetôséget is elôre látott.
Ezzel megnyitotta az utat a molekulaszerkezet végsô soron
intuíción és logikán alapuló vizsgálatához,
amely a sztereokémia. elsô fél évszázadának
olyan sok nagyszerû és máig érvényes
eredményéhez vezetett. Kevés területe van a természettudományoknak,
ahol a konkrét kísérleti anyag és a közvetlenül
nem vizsgálható, elvont elméleti kép összhangja
olyan maradandó eredményeket hozott, mint a sztereokémiában,
s ráadásul az anyag szerkezetének olyan részleteire
vonatkozóan, melyek közvetlen vizsgálatára abban
az idôben remény sem lehetett.
Van't Hoff elsô kis dolgozatának megjelenése
után egy évvel részletesebben kifejtette a szénvegyületek
térszerkezetérõl
alkotott nézeteit. A francia nyelven megjelent könyv címe:
"La chimie dans l'espace". Kémia a térben...
Ez a
képzettársítás, ez a gondolat a kémia
legalapvetôbb lényegét fejezi ki, s egyúttal
kijelöli a kémia helyét az anyag sajátságait
kutató természettudományok között.
A kémia az anyag sajátságait a molekuláris
szervezettség szintjén tanulmányozza. A molekuláris
szervezôdés a térbeli struktúra kialakításának
a legelsô, lagalapvetôbb szintje az anyag evolúciója
során. Az elemi részek alakjában realizálódó
anyag, illetve az atomokká szervezôdô elemi részek
– legalábbis mai ismereteink szerint – térbelileg "strukturálatlanok",
pontosabban gömbszimmetrikusak, akár a csillagok. A térbeli
szervezôdés elsô foka a molekulákká egyesült
atomok térszerkezetében lép fel, s aztán bonyolódik
egyre tovább a makromolekulák, a polimolekulás rendszerek,
a sejtek és a sok sejtbôl felépülô élô
szervezetek sokrétûen szervezett térbeli struktúráivá.
Az anyag evolúciójának legmagasabb
szintjén, az élô rendszerekben a mûködés,
a funkció szervezettsége a folyamatok idôbeli és
térbeli szervezettségén alapul, amire a térben
igen bonyolultan szervezett struktúra adja meg a lehetôséget.
Az élô rendszerekre a struktúra és a funkció
tökéletes egybehangolódása, mintegy azonosulása
a jellemzô. A térbeli szervezettség fokozódó
bonyolultsága az útja az anyag élôvé
organizálódásának. Ennek a hatalmas hierarchiának
az elsô szintje és alapja g molekulák térbeli
szervezettsége. Az életfolyamatok molekuláris
alapjait kutató molekuláris biológiát Kendrew
és Perutz, Watson, Crick
és Wilkins
alapjában véve sztereokémiai vizsgálatai
alapozták meg a fehérjék és a nukleinsavak
térszerkezetének feltárásával. Az enzimek
mûködése térszerkezetük ismerete alapján
vált érthetôvé. Ezzel kapcsolatban elvileg is
döntô az a felismerés, hogy az enzimek rendkívül
specifikus térszerkezetének kialakításában
ugyanazok az egyszerû kölcsönhatások érvényesülnek,
melyek a legegyszerûbb molekulák térszerkezetét
is megszabják. Az enzimek ugyanolyan molekulák, mint a szerves
vegyületek legegyszerûbb "közkatonái", csak az enzimekben
sok ezer atom együttmûködô
kölcsönhatása
összegezôdik
a magasabb rendû és specifikusabb funkciók ellátására
is alkalmas, bonyolultan szervezett térszerkezet kialakításában.
Távol vagyunk attól, hogy az élet lényegének kérdését boncolgassuk. Azt azonban már látjuk, hogy az összehangolt. mûködés bonyolult térbeli struktúrákhoz van kötve, melynek a térben szervezett molekulák és molekuláris rendszerek az alapkövei. A kémia tehát éppen a sztereokémián keresztül járul hozzá a legmélyebben az anyag szervezôdésérôl alkotott képünk kialakításához. S ennek az egész szemléletnek a magja valahol a két fiatal kémikus, van't Hoff és Le Bel százesztendôs gondolatában rejlik, hogy az anyag sajátságait csak a molekulák térbeli szerkezetének megismerésén keresztül érthetjük meg.
| ChemoNet, 1998
Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |