Hogy a Volta-oszlop tulajdonságait megismerhessétek és az elônyeit megbecsülhessétek, néhány kísérletet csinálunk. Mindenekelôtt néhány anyagot teszünk ki a hatásának, e hatásokat már elôbbi kísérleteinkbôl ismerjük, most meglátjuk, készülékünk hogyan viselkedik. Itt van egy kevés réz (figyeljétek meg, micsoda változásokon megy keresztül), aztán itt van ez a salétromsav; az utóbbinak nagyon nagy a vegyi hatóereje, jelentékeny hatást gyakorol a rézre, ha azzal érintkezik. Látjátok, milyen szép vörös gôz száll fel, miután e gôzre nincsen szükségünk, és nem is akarjuk belehelni, Anderson úr az edényt a csô alá tartja, hogy a kísérlet szépségeibôl és hasznából részünket kivehessük, anélkül hogy annak kellemetlenségeit viselnünk kellene. A palackba tett réz felbomlik és a savat meg a vizet olyan kék folyadékká változtatja, mely rezet és még más anyagokat tartalmaz; most meg akarom nektek mutatni, hogy a Volta-oszlop mit csinál vele. Közben azonban még egy más kísérletet is végigcsinálunk, hogy az erejét kipróbáljuk. Itt van ez az anyag: víznek látszik, azaz oly alkatrészeket tartalmaz, melyeket még nem ismerünk, éppúgy, mint a víz alkatrészeit sem ismerjük még. Ezt a sóoldatot papírra helyezzük, szétteregetjük, és a villamos elem erejét rajta kipróbáljuk. Lássuk csak, mi lesz! Három vagy négy oly fontos dolog történik, melybôl hasznot akarunk húzni. E nedves papirost cinklemezre tesszük, ez erre a célra nagyon alkalmas; íme, az oldat egyáltalában nem változott sem a papír által, amelyre ráöntöttem, és a cinklap sem másvalami által, amivel érintkezésbe hoztam; szóval egészen nyugodtan a készülékünk hatása alá bocsáthatjuk. Elôbb azonban nézzük meg, hogy az rendben van-e? Itt vannak a drótok. Lássuk csak, hogy olyan állapotban vannak-e még, mint legutóbb? Arról rögtön meggyôzôdhetünk. Ha a drótok végét most egymáshoz teszem, a villamosság ereje nem jelentkezik, mert a vezeték (elektródnak nevezzük), az elektromosság útja, átjárója, meg van szakítva, de most azt telegrafálja (közben a hirtelen felvillanó fényre mutat), hogy minden készen van. Mielôtt belefogunk a kísérletbe, Anderson úr a villamos elem kapcsolatát ismét szakítsa meg mögöttem, egy platinadrótot feszítsünk a pólusok közé, és ha úgy találom, hogy e drótot meglehetôs hosszúságban izzóvá tudom tenni, akkor kísérletünk eredményessége már biztosítottnak látszik. Rögtön meglátjátok erejének hatását. (A kapcsolatot hetyreállítják és a drót pirosan izzik.) A villamos erô pompásan áthalad a dróton; nos, miután jelenlétében bizonyosak lehetünk, most már felhasználhatjuk a víz megvizsgálására.
Két platinalemezem van, és ha erre a papiroslapra helyezem (a cinklapon levô nedves papirosra), akkor nem láttok semmit; felemelem, úgy-e nem állott be semmiféle változás, minden úgy van még, mint azelôtt. Lássátok csak, mi lesz akkor, ha e két pólust (a villamos elem drótjainak végét) kezembe veszem, és az egyiket vagy másikat külön a platinalemezre teszem, semmi sem történik – mindkettô hatástalan; de ha ugyanabban a pillanatban egyszerre kapcsolatot teremtek közöttük – látjátok, mi történik? (A villamos elem két pólusa alatt sötét folt jelentkezik.) Nini, a fehér felületrôl valami sötét vált le. Biztos vagyok benne, ha a cinklemezen levô drótot a papírlap túlsó felére helyezem, éppen olyan szépen hat a papirosra is. Meg is próbálom, hogy nem írhatnék-e rája valamit – talán egy táviratot. (Az elôadó a drót végével a papírlapra ráirja: "Ifjak".) Úgy-e, mily csodaszép eredmény?
Remélem, tudjátok, hogy ebbôl az oldatból olyasvalamit vonhatunk ki, amelynek mivoltával elôbb nem voltunk tisztában. Most Anderson úr átadja nekünk a kezében levô palackot, és próbáljuk meg, mit tudunk belôle kivonni. Mint tudjátok, olyan folyadékot tartalmaz, melyet rézbôl és salétromsavból az imént készítettünk; miközben más kísérlettel foglalkoztunk. Noha a kísérletemmel kissé sietnem kell, és bizony néhány kisebb hiba is belecsúszhat, mégis jobb lesz, ha végignézitek, hogy mit csinálok, mintha mindent elôre elkészítenék.
Vigyázzatok csak, mi lesz most! E két platinalemez a készülék két vége (helyesebben rögtön azzá teszem). Ezt most érintkezésbe hozom azzal az oldattal. Éppúgy, mint ahogy a papirlappal tettem. Ne törödjûnk vele, hogy az oldat a papirosban vagy üvegben van-e, az a fô, hogy a készülék vele érintkezzék. Ha e két platinalemezt, úgy ahogy van, belemártom, éppoly tisztán kerül ki belôle, mint ahogy belejutott (a folyadékba mártja, anélkül hogy az elemmel egybekapcsolta volna), de ha az elem eréjét mûködésbe hozzuk, és úgy mártjuk bele (a lemezeket összekapcsolja a villamos battériával és belemártja azokat a folyadékba), no lám (az egyik lemezt kiveszi), mintha hirtelen rézzé vált volna; olyan, mint valami kicsi réztányér (kihúzza a másik platinalemezt), ez a lemez ellenben egészen tisztán jött ki belôle. Ha ezt a berezesedett darabot a másik oldalra helyezem, akkor a réz a jobb oldalról a bal oldalra vándorol; az elôbb rezes felület ezúttal megtisztul és az a lemez, mely az elôbb tiszta volt, most rézzel bevonva került ki az oldatból; no már most azt a rezet, amelyet az oldatban felhasználtunk, a készülékünkkel ily módon ismét kivonhatjuk a folyadékból.

mely kevés savat tartalmaz (ezzel megkönnyitem a hatást, de egyébként nem befolyásolom a folyamatot) és az edény nyílását egy lefelé hajló csôvel (D) kötöm össze, a csô arra a csôre emlékeztet bennünket, mely a kályhával folytatott kísérletünknél alkalmazott puskacsôvel volt összekötve és most az F edény aljába torkoll. A készülékünk készen van és most kipróbálhatjuk a vízre gyakorolt hatását. Az elôbb izzó csövön keresztülvezettem a vizet, most ellenben villamosságot vezetek az edény tartalmán keresztül. Talán felforr a víz; és ha felforr, akkor gôz keletkezik, azt már tudjátok, hogy a gôz, ha lehûl, lecsapódik, és ebbôl meglátjátok, hogy vizet forralok-e vagy sem? De meglehet, hogy nem tudom felforralni, hanem más jelenséget idézek elô. Vigyázzatok csak! Az egyik drótot erre az oldalra (A), emezt pedig a másik oldalra (B) helyezem, vajjon beáll-e valami változás? Mintha forrna; de csakugyan forr? Lássuk csak, hogy gôz formájában jelentkezik-e vagy sem. Úgy hiszem, az edény (F) azonnal megtelne gôzzel, ha az, ami a vízbôl felszáll, gôz lenne. De hát gôz lehet ez? Semmi esetre sem! Hisz látjátok, hogy változatlan maradt. A víz felett marad, tehát nyilván állandó (le nem csapódható ) gázzal van dolgunk. De hát micsoda? Hidrogén? Vagy valami más? Lássuk csak, micsoda? Ha hidrogén, akkor égni fog. (Az elôadó a felgyülemlett gáz egy részét meggyújtja, és az robbanással elég.) Nyilván gyúlékony anyag, de nem oly módon gyullad ki, mint a hidrogén; mert a hidrogén nem csapott volna akkora zajt, de az égésnél jelentkezô láng színe hasonlít a hidrogén lángjához. De még valami különös dolgot figyelhetünk meg: mégpedig azt, hogy levegô hozzájárulása nélkül égett. Hogy e jelenség különös tulajdonságait nektek megmutathassam, még egy készüléket állíttattam fel. Nyílt edény helyébe zárt edényt tettem, és megmutatom, hogy ez a gáz, bármi legyen is az, azzal a képességgel rendelkezik, hogy levegô nélkül is éghet, és e tekintetben különbözik a gyertyától, mely leyegô nélkül nem éghet. A következôképpen csinálom ezt. Ez az üvegedény (G) két platinadróttal (K és I) van összekötve; elektromos szikrát pattanthatok át velük; az edényt légszivattyúra helyezhetjük és a levegôt kiszivattyúzhatjuk. Ha ez megtörtént, akkor az (F) edényre erôsitjük, a H, H, H csapokat kinyitjuk és azt a gázt belébocsáthatjuk, mely a Volta-oszlopnak a vízre gyakorolt hatásából kifolyólag keletkezett, szóval azt a gázt, amelyet a víz elváltozása következtében a vízbõl nyertünk – mert most már ott tartunk, hogy elmondhatom, hogy kísérletünkkel a vizet gázzá változtattuk. Nemcsak a lényegét változtattuk meg, hanem a valóságban teljesen e gáznemû testté formáltam át. Szóval ha a G edényt az F edény tetejére rácsavarom, amennyiben a csöveket jól összekapcsolom, a csapokat kinyitom, akkor a víznek az F edénybe való feltódulásán láthatjátok, hogy a gáz felemelkedik. Az edény egészen megtelt vele, a csapot lezárom, az edényt óvatosan leveszem és a Leydeni palackból (L) villamos szikrát pattantok át, miáltal az edény, mely most még egészen tiszta, zavarossá válik. Az edény azért nem pattan széjjel, mert elég erôs arra, hogy a robbanást kibírja. (Az elôadó szikrát pattant át és ezáltal a robbanásra alkalmas keverék meggyullad.) Nini, hogy ragyog! Ha ezt az edényt ismét az alsó edényre csavarom és a csapot kinyitom, a víz feltódulásából arra következtethettek, hogy a gáz másodszor is felszáll. (Kinyitja a csapokat.) Az a gáz, mely az elôbb az edényben felgyülemlett és amelyet a villamos szikra meggyújtott, eltûnt, mint látjátok, a helye kiürült és újabb gáz tódul oda. Víz képzôdött és ha kísérletünket megismételjük, ismét üres teret nyerünk, amit a víz feltódulása is igazol. A robbanás után mindig kiürül az edény, mert az a gôz vagy gáz, mellyé az elektromos elem a vizet elváltoztatta, a szikra átcsapódása következtében felrobban és ismét vízzé válik, és meglátjátok, hogy egyre-egyre néhány vízcsepp csurog le a felsô edény oldalán és alul felgyülemlik.
Ezúttal a szabad levegô kizárásával állítottunk elô vizet. A gyertyából eredô víz a levegô közbenjöttével jött létre; de ezúttal attól függetlenül keletkezett. Eképpen a víznek azt a másik anyagot kell tartalmaznia, melyet a gyertya a levegôbôl kivon és amelybôl a hidrogénnel vegyülve víz keletkezik.
 Az imént
Iáttátok, hogy a villamos battéria egyik vége
azt a rezet magához vonzotta, melyet az edényben levô
kék folyadékból kivont. Ezt ezzel a dróttal
vitte végbe; és ha a villamos battéria a fémoldatra
oly erôt gyakorol, melyet mi tetszés szerint mûködésbe
hozhatunk vagy megszüntethetünk, nem kézenfekvô-e,
ha azt kérdezzük, hogy talán a vizet is alkatrészeire
bonthatjuk és azokat felcserélhetjük? Próbáljuk
meg! Itt vannak a pólusok, – a battéria fémbôl
készült végei – nézzük csak, mi történik
a vízzel ebben a készülékben, hol a pólusok
messzire vannak egymástól. Az egyiket erre az oldalra (A),
a másikat a túlsó oldalra (B) teszem, itt van ez az
átlyuggatott kicsi deszka, ezt a pólusokra helyezhetem és
úgy rájuk illeszthetem, hogy az, ami a battéria végei
mellôl kijô, mint felbontott gáz jelentkezik; ugyanis
már az elôbb láttátok, hogy a víz nem
gôzzé, hanem gázzá vált. A drótok
most a legteljesebb kapcsolatban vannak azzal az edénnyel, amelyben
víz van, buborékok szállnak fel; fogjuk fel és
vizsgáljuk meg azokat. Ezt az üveghengert (O) megtöltöm
vízzel és az A végre helyezem; aztán veszek
egy másikat (H) és azt a B végre helyezem. (20. ábra.)
Most már kettôs készülékünk van; mindkét
helyen gáz szabadul fel. Mindkét edény megtelik gázzal.
Nini, már el is kezdôdött; a jobb oldali (H) nagyon gyorsan
megtelik, a baloldali (O) már nem oly gyorsan; noha úgy csináltam,
hogy néhány buborék elillant; a folyamat mégis
meglehetôs szabályossággal megy végbe. És
ha az egyik edény nem nagyobb, mint a másik, akkor meglátjátok,
hogy az egyikben (H) a térfogatához képest kétszer
annyi gyülemlik fel, mint a másikban (O). Mindkét gáz
színtelen. A víz fölött maradnak, anélkül
hogy lecsapódnának, mintha tökéletesen egyformák
lennének – úgy hiszem, legalább látszatra azok.
De kitûnô alkalom kínálkozik egyúttal
számunkra, hogy ezeket az anyagokat megvizsgáljuk és
igazi természetüket meghatározzuk. Elég nagy
tömegben állanak rendelkezésünkre, könnyen
kísérletezhetünk velük. Mindenekelôtt ezt
az edényt (H) veszem elô és felszólítlak
benneteket, legyetek készen arra, hogy a hidrogént felismerjétek.
Az imént
Iáttátok, hogy a villamos battéria egyik vége
azt a rezet magához vonzotta, melyet az edényben levô
kék folyadékból kivont. Ezt ezzel a dróttal
vitte végbe; és ha a villamos battéria a fémoldatra
oly erôt gyakorol, melyet mi tetszés szerint mûködésbe
hozhatunk vagy megszüntethetünk, nem kézenfekvô-e,
ha azt kérdezzük, hogy talán a vizet is alkatrészeire
bonthatjuk és azokat felcserélhetjük? Próbáljuk
meg! Itt vannak a pólusok, – a battéria fémbôl
készült végei – nézzük csak, mi történik
a vízzel ebben a készülékben, hol a pólusok
messzire vannak egymástól. Az egyiket erre az oldalra (A),
a másikat a túlsó oldalra (B) teszem, itt van ez az
átlyuggatott kicsi deszka, ezt a pólusokra helyezhetem és
úgy rájuk illeszthetem, hogy az, ami a battéria végei
mellôl kijô, mint felbontott gáz jelentkezik; ugyanis
már az elôbb láttátok, hogy a víz nem
gôzzé, hanem gázzá vált. A drótok
most a legteljesebb kapcsolatban vannak azzal az edénnyel, amelyben
víz van, buborékok szállnak fel; fogjuk fel és
vizsgáljuk meg azokat. Ezt az üveghengert (O) megtöltöm
vízzel és az A végre helyezem; aztán veszek
egy másikat (H) és azt a B végre helyezem. (20. ábra.)
Most már kettôs készülékünk van; mindkét
helyen gáz szabadul fel. Mindkét edény megtelik gázzal.
Nini, már el is kezdôdött; a jobb oldali (H) nagyon gyorsan
megtelik, a baloldali (O) már nem oly gyorsan; noha úgy csináltam,
hogy néhány buborék elillant; a folyamat mégis
meglehetôs szabályossággal megy végbe. És
ha az egyik edény nem nagyobb, mint a másik, akkor meglátjátok,
hogy az egyikben (H) a térfogatához képest kétszer
annyi gyülemlik fel, mint a másikban (O). Mindkét gáz
színtelen. A víz fölött maradnak, anélkül
hogy lecsapódnának, mintha tökéletesen egyformák
lennének – úgy hiszem, legalább látszatra azok.
De kitûnô alkalom kínálkozik egyúttal
számunkra, hogy ezeket az anyagokat megvizsgáljuk és
igazi természetüket meghatározzuk. Elég nagy
tömegben állanak rendelkezésünkre, könnyen
kísérletezhetünk velük. Mindenekelôtt ezt
az edényt (H) veszem elô és felszólítlak
benneteket, legyetek készen arra, hogy a hidrogént felismerjétek.
Emlékezzetek valamennyi tulajdonságára – könnyû gáz, mely jól megmarad a felfordított edényben, a palack nyílásán halovány lánggal égett – és most nézzetek ide, vajjon ez a gáz nem felel-e meg mindezeknek a feltételeknek? Ha hidrogén, akkor megmarad, míg az edényt felfordítom. (Az elôadó gyertyát tart oda és a hidrogén meggyullad.) Hát a másik edényben ugyan mi van? Azt már tudjátok, hogy e két gáz egyesülve, robbanó vegyületet adott. Mi is lehet az, amit a vízben, mint annak másik alkatrészét felleltünk és amelynek ennélfogva annak az anyagnak kell lennie, mely a hidrogént lángra lobbantja? Azt jól tudjuk, hogy az a víz, melyet az edénybe juttattunk, két testbôl áll. Azt is tudjuk, hogy közülük az egyik hidrogén; mi is lehet a másik, mely a kísérlet elôtt még a vízben volt és amelyet ime külön egymagában is felfogtunk? Ezt az égô faforgácsot az üvegbe dugom. Nini, a gáz maga nem ég, azonban a forgács lángját felszítja. Látjátok, hogy gyorsítja az égést? A fa sokkal jobban ég, mint a szabad levegõn. Úgy ebbôl látjátok azt is, hogy a víznek ez a másik alkatrésze; ha a víz a gyertya elégése alkalmával képzôdik, a levegôbôl vonatott ki. Hogy nevezzük el ezt az anyagot: A-nak, B-nek vagy C-nek. Nevezzük O-nak – oxigénnek. Ez a neve. Szóval ez itt oxigén, amelyet a víz másik alkatrészeképpen vontunk ki.
Lassan-lassan mélyebb betekintést nyerünk a témánkba és mihamar megértjük, miért ég a gyertya a levegôn. A víz analizálása, azaz alkatrészeire való felbontása alkalmával két térfogat hidrogént és egy térfogat oxigént nyerünk. Ezt az arányt a következô ábra mutatja és egyben mindkét test súlya is fel van sorolva, melybôl látjuk, hogy az oxigén mennyivel nehezebb, mint a hidrogén.

| oxigén | 88,9 | |
| hidrogén | 11,1 | |
|
|
||
| víz | 100,0 |
 Miután láttuk,
hogy vonhatunk ki oxigént a vízbôl, még azt
is megmutatom, mily k0nnyen állitható elô nagy mennyiségben.
Az oxigén, mint ezt magatok is könnyûszerrel elképzelhetitek,
a levegôben van, különben hogy fejleszthetne ki magából
az égô gyertya vizet, mely oxigént tartalmaz? Hisz
teljesen lehetetlen lenne vizet termelni oxigén nélkül
– az kémiai lehetetlenség. A levegôbôl elôállíthatunk
oxigént? Nos, több hosszadalmas és nehézkes folyamatot
ismerünk, mellyel elôállíthatjuk, de jobb módot
is tudunk. Itt van a barnakô, nem valami tekintélyes; de nagyon
hasznos ásvány. Ha a barnakövet izzóvá
hevítjük, oxigént ád. Ebben a vaspalackban (21.
ábra) barnakô van, nyakába elvezetô csô
van illesztve. A tûz már ég, Anderson úr lesz
szíves a retortát (csôvel ellátott zárt
edény; a csõ az edény tartalmának felhevítése
által keletkezô gázokat vagy gôzöket elvezeti
vagy felfogja) idehozni, a meleget az könnyen kibírja, hisz
vasból van. – Itt van ez a só, klórsavas kálinak
hívják, nagyobb mennyiségben használják
fel a tûzijáték-készítésnél,
azonkívül vegyészeti, gyógyászati és
más célokra. Belôle egy keveset barnakôvel keverünk
(rézoxid vagy vasoxid is megteszi ugyanazt a szolgálatot,
mint a barnakô) és ha e keveréket retortába
teszem, nem is kell izzó hôfok hozzá, hogy belôle
oxigént fejlesszek. Nem szándékozom belôle sokat
csinálni, csak annyit, amennyi a kísérletünkhöz
elégséges; de nagyon kevés keveréket sem tehetek
bele, mert az a gáz, mely a retortában legelôbb fejlõdik,
levegôvel van keverve, és azért ezt a részt,
a gáz elejét, fel kell áldoznom és ki kell
szorítanom. Meglátjátok, hogy a közönséges
borszeszláng is elégséges arra, hogy oxigént
fejleszthessünk, és pedig kétféle eljárással
szoktunk oxigént elôállítani. No lám,
mily bôségesen ad gázt e kis keverék. Vizsgáljuk
csak meg és állapítsuk meg tulajdonságait.
Mint látjátok, ily módon ugyanolyan gázt kaptunk,
mint amilyent a villamos elemmel végzett kísérletünk
szolgáltatott. Átlátszó, a vízben oldhatatlan,
a levegô látható tulajdonságaival megegyezik.
(Miután az elsô edény oly levegôt tartalmaz,
mely az elsô adag oxigénnel együtt illant el, félretesszük
és így kísérleteinket teljesen szabalyszerû
és megbízható módon folytatjuk le.) Annál
az oxigénnél, melyet az imént a Volta-féle
elemmel, a vízból vontunk ki, feltûnô módon
megállapíthattuk, hogy a faforgácsnak, a gyertyának
stb. égését kedvezôen befolyásolhatja
és ugyanezeket a tulajdonságokat itt is feltételezhetjük.
Próbáljuk meg!
Miután láttuk,
hogy vonhatunk ki oxigént a vízbôl, még azt
is megmutatom, mily k0nnyen állitható elô nagy mennyiségben.
Az oxigén, mint ezt magatok is könnyûszerrel elképzelhetitek,
a levegôben van, különben hogy fejleszthetne ki magából
az égô gyertya vizet, mely oxigént tartalmaz? Hisz
teljesen lehetetlen lenne vizet termelni oxigén nélkül
– az kémiai lehetetlenség. A levegôbôl elôállíthatunk
oxigént? Nos, több hosszadalmas és nehézkes folyamatot
ismerünk, mellyel elôállíthatjuk, de jobb módot
is tudunk. Itt van a barnakô, nem valami tekintélyes; de nagyon
hasznos ásvány. Ha a barnakövet izzóvá
hevítjük, oxigént ád. Ebben a vaspalackban (21.
ábra) barnakô van, nyakába elvezetô csô
van illesztve. A tûz már ég, Anderson úr lesz
szíves a retortát (csôvel ellátott zárt
edény; a csõ az edény tartalmának felhevítése
által keletkezô gázokat vagy gôzöket elvezeti
vagy felfogja) idehozni, a meleget az könnyen kibírja, hisz
vasból van. – Itt van ez a só, klórsavas kálinak
hívják, nagyobb mennyiségben használják
fel a tûzijáték-készítésnél,
azonkívül vegyészeti, gyógyászati és
más célokra. Belôle egy keveset barnakôvel keverünk
(rézoxid vagy vasoxid is megteszi ugyanazt a szolgálatot,
mint a barnakô) és ha e keveréket retortába
teszem, nem is kell izzó hôfok hozzá, hogy belôle
oxigént fejlesszek. Nem szándékozom belôle sokat
csinálni, csak annyit, amennyi a kísérletünkhöz
elégséges; de nagyon kevés keveréket sem tehetek
bele, mert az a gáz, mely a retortában legelôbb fejlõdik,
levegôvel van keverve, és azért ezt a részt,
a gáz elejét, fel kell áldoznom és ki kell
szorítanom. Meglátjátok, hogy a közönséges
borszeszláng is elégséges arra, hogy oxigént
fejleszthessünk, és pedig kétféle eljárással
szoktunk oxigént elôállítani. No lám,
mily bôségesen ad gázt e kis keverék. Vizsgáljuk
csak meg és állapítsuk meg tulajdonságait.
Mint látjátok, ily módon ugyanolyan gázt kaptunk,
mint amilyent a villamos elemmel végzett kísérletünk
szolgáltatott. Átlátszó, a vízben oldhatatlan,
a levegô látható tulajdonságaival megegyezik.
(Miután az elsô edény oly levegôt tartalmaz,
mely az elsô adag oxigénnel együtt illant el, félretesszük
és így kísérleteinket teljesen szabalyszerû
és megbízható módon folytatjuk le.) Annál
az oxigénnél, melyet az imént a Volta-féle
elemmel, a vízból vontunk ki, feltûnô módon
megállapíthattuk, hogy a faforgácsnak, a gyertyának
stb. égését kedvezôen befolyásolhatja
és ugyanezeket a tulajdonságokat itt is feltételezhetjük.
Próbáljuk meg!
 Idenézzetek:
így ég a viaszrúd (22. ábra) a közönséges
levegôben, és ha a viaszrudat az edényben tartom, íme,
ebben a gázban ég! No lám, mily fényesen, szép
tisztán ég!. De még mást is láthattok,
– azt már tudjátok, hogy nehéz gáz, míg
a hidrogén mint valami ballon a levegôbe emelkedik, sôt
még gyorsabhan, mint a gömb, ha a burkolat súlya nem
nehezedik reája. Úgy-e megértettétek, hogy
ha a vízbôl a térfogatához képest kétszerannyi
hidrogént is nyerhetek, mint oxigént, abból még
nem következik, hogy az elôbbinek a súlya is kétszer
annyi; az egyik ugyanis nehéz, a másik pedig nagyon könnyû
gáz. Van eszközünk, hogy a lég- vagy gáznemû
anyagokat megmérhessük; de nem akarom most azzal az idôt
tölteni; egyszerûen megmondom, hogy mennyit nyomnak. A különbség
közöttük nagyon jelentékeny: 1 köbláb
hidrogén 1/12 uncia, 1 köbláb oxigén
pedig 11/3 uncia. Az oxigén szóval 16-szor
oly nehéz, mint ugyanannyi térfogatú hidrogén.
Idenézzetek:
így ég a viaszrúd (22. ábra) a közönséges
levegôben, és ha a viaszrudat az edényben tartom, íme,
ebben a gázban ég! No lám, mily fényesen, szép
tisztán ég!. De még mást is láthattok,
– azt már tudjátok, hogy nehéz gáz, míg
a hidrogén mint valami ballon a levegôbe emelkedik, sôt
még gyorsabhan, mint a gömb, ha a burkolat súlya nem
nehezedik reája. Úgy-e megértettétek, hogy
ha a vízbôl a térfogatához képest kétszerannyi
hidrogént is nyerhetek, mint oxigént, abból még
nem következik, hogy az elôbbinek a súlya is kétszer
annyi; az egyik ugyanis nehéz, a másik pedig nagyon könnyû
gáz. Van eszközünk, hogy a lég- vagy gáznemû
anyagokat megmérhessük; de nem akarom most azzal az idôt
tölteni; egyszerûen megmondom, hogy mennyit nyomnak. A különbség
közöttük nagyon jelentékeny: 1 köbláb
hidrogén 1/12 uncia, 1 köbláb oxigén
pedig 11/3 uncia. Az oxigén szóval 16-szor
oly nehéz, mint ugyanannyi térfogatú hidrogén.
Hogy megmutassam az oxigénnek azt a különös tulajdonságát, mellyel az elégést elôsegíti, helyesebben hogy a levegôvel összehasonlítsuk, ezt a kis darab gyertyát meggyújtom; ámbár a kísérlet durván fog sikerülni. Nos, a gyertya ég a levegôn; hogy ég majd az oxigénben? Itt van ez az edény, oxigén van benne; a gyertya fölé tartom, hogy a gáz hatását a levegô hatásával összehasonlíthassam. Jól vigyázzatok; olyanforma lesz, mint a villamos elem pólusán levô fény volt az elôbb. Mily erôs lehetett az oxigén hatása ! És e folyamat alatt mégsem keletkezik más, mint ami a gyertya elégése alatt keletkezett. Ugyanúgy víz keletkezett, – éppen oly módon – bárhol égettük el a gyertyát, a levegôn vagy gázban, mindegy.
Még egynéhány kísérletet mutatok
be nektek, melyben az oxigénnek az égést fenntartó
igazán csodálatos ereje még világosabban megmutatkozik.
Itt van például ez a lámpa; az egyszerûsége
mellett mintája sok fajta lámpának, mely különbözô
célokra készült – mint például a világitótorony
lámpájának, mikroszkopikus lámpának
stb.; ha csak az a célunk, hogy jó fényesen égjen,
könnyen azt kérdezhetitek: ha a gyertya az oxigénben
jobban ég, miért nem ég a lámpa is jobban?
– Nos, jobban is ég. Anderson úr lesz szíves azt a
csövet ideadni, mely az oxigéntartányból való,
és e lánghoz illesztem, melyet szándékosan
gyengén égetek. Most oxigént bocsátok bele
– hó, mily pompásan hat rá. De ha a csapot elzárom,
mi lesz a lámpával? (Az oxigénáram megszakad
és a lámpa ismét homályosan ég.) Igazán
csodálatos, mennyire meggyorsithatjuk oxigénnel az égést.
 És
nemcsak a hidrogénlángnál, az égô gyertyánál
vagy szénnél, hanem minden rendes égésnél
így van ez. Azt már láttátok, hogy például
a vas hogyan ég el az atmoszférikus levegôben; kíséreljük
meg azt is, hogyan ég az oxigénben. Itt van ez az oxigénnel
teli üveg, aztán itt van ez a vashuzal; de olyan vastag rúd
is lehet, mint az öklöm – éppúgy ég az is.
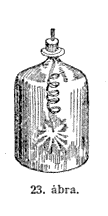
Elôbb egy fadarabkát erôsitek a drót végére,
meggyújtom a fát és a dróttal együtt az
edénybe engedem (23. ábra.), A fa tüzet fog és
úgy ég, amint a fa az oxigénben égni szokott,
de az égés a vasra is átterjed. No lám, mily
pompásan ég a vas és hosszú ideig égni
fog. Ha egyre friss oxigént vezetünk az edénybe, a vas
égését fenntarthatjuk, míg csak egészen
el nem emészti a tûz.
És
nemcsak a hidrogénlángnál, az égô gyertyánál
vagy szénnél, hanem minden rendes égésnél
így van ez. Azt már láttátok, hogy például
a vas hogyan ég el az atmoszférikus levegôben; kíséreljük
meg azt is, hogyan ég az oxigénben. Itt van ez az oxigénnel
teli üveg, aztán itt van ez a vashuzal; de olyan vastag rúd
is lehet, mint az öklöm – éppúgy ég az is.
Elôbb egy fadarabkát erôsitek a drót végére,
meggyújtom a fát és a dróttal együtt az
edénybe engedem (23. ábra.), A fa tüzet fog és
úgy ég, amint a fa az oxigénben égni szokott,
de az égés a vasra is átterjed. No lám, mily
pompásan ég a vas és hosszú ideig égni
fog. Ha egyre friss oxigént vezetünk az edénybe, a vas
égését fenntarthatjuk, míg csak egészen
el nem emészti a tûz.
 De most
hagyjuk ezt, hadd figyeljük meg más anyagok elégését
is; rövid az idô, ne pocsékoljuk. Vegyünk elô
egy kis kéndarabot, azt már tudjátok, hogyan ég
a kén a levegôn; most tegyük oxigénbe és
ismét meggyôzôdhettek róla, hogy az az anyag,
mely a levegôn ég, hasonlíthatatlanul élénkebben
ég az oxigénben. És e tapasztalat azt a gondolatot
kell hogy ébressze fel bennetek, hogy a levegô csupán
e gáznak köszönheti az égést fenntartó
tulajdonságát. A kén most egészen nyugodtan
ég az oxigénben, de egy pillanatra sem téveszthetitek
össze azzal, ahogy a puszta levegôn ég (24. ábra.).
De most
hagyjuk ezt, hadd figyeljük meg más anyagok elégését
is; rövid az idô, ne pocsékoljuk. Vegyünk elô
egy kis kéndarabot, azt már tudjátok, hogyan ég
a kén a levegôn; most tegyük oxigénbe és
ismét meggyôzôdhettek róla, hogy az az anyag,
mely a levegôn ég, hasonlíthatatlanul élénkebben
ég az oxigénben. És e tapasztalat azt a gondolatot
kell hogy ébressze fel bennetek, hogy a levegô csupán
e gáznak köszönheti az égést fenntartó
tulajdonságát. A kén most egészen nyugodtan
ég az oxigénben, de egy pillanatra sem téveszthetitek
össze azzal, ahogy a puszta levegôn ég (24. ábra.).
A foszfor elégését is meg akarom még nektek mutatni és azt itt könnyeben megtehetem, mint ti odahaza. A foszfor tudvalevôen nagyon gyúlékony anyag és már a levegõn is könnyen ég, hát még a tiszta oxigénben! De ezt a kísérletet nagyon óvatosan kell végigcsinálnom, mert az egész készülék könnyen felrobbanhat, még így is alig fogjuk tudni ennek az edénynek a szétrepedését megakadályozni. No lám, így ég a foszfor a levegôn. De mily pompás fényt lövell az oxigénben ! Nini, hogy pattannak le az egyes darabkák, elsodródnak, mindegyik külön-külön heves lángra lobban és vakító fény keletkezik ezáltal.
Egyelôre ennyit az oxigénnek arról a képességérôl, mellyel más testek elégését oly élénkké teszi. A legközelebbi feladatunk az, hogy a hidrogénhez való viszonyát közelebbrôl szemügyre vegyük.
Még emlékeztek rá, hogy a vizet oxigénre és hidrogénre bontottuk, aztán ezek keverékét meggyújtottuk és közben kisebb fajta robbanás keletkezett. Arra is emlékeztek, hogy edényben oxigént és hidrogént együtt elégettünk és akkor gyenge fény, de nagy hô keletkezett. Íme, a két gázt ezúttal oly arányban kevertem, mint ahogy a vízben van és e keveréket meg akarom gyújtani. Ebben az edényben pontosan egy térfogat oxigén és két térfogat hidrogén van; szóval e keverék teljesen azonos annak a gáznak a tartalmával, melyet a villamos áram segítségével a víz szétbontásakor nyertünk. De minthogy nem akarom rögtön az egész mennyiséget meggyújtani, – egyszerre sok lenne – ezért szappanos vizet készítettem, abba vezetem a gázkeveréket, hogy szappanbuborékok keletkezzenek, melyek megtelnek velük; e szappanbuborékokat gyújtom meg aztán és ilyformán nagyon egyszerûen megfigyelhetjük az oxigénnek hidrogénnel való elégését. Mindenekelôtt fejlesszünk szappanbuborékokat. A gázkeveréket ezen az agyagpipán keresztül a szappanos vízbe vezetem, nos, gáz megy bele és már itt is van a buborék. Felfogom a kezemmel. Úgy-e azt hiszitek, hogy ez igazán nagy vigyázatlanság tôlem; de csak azt akarom nektek megmutatni, hogy puszta lármától, csattogástól még nem kell mindjárt megijedni. (Az elôadó égô gyújtószállal megközelíti a buborékot és az felrobban.) De figyelmeztetlek benneteket, nehogy eszetekbe jusson a buborékot közvetlenül a pipa nyílásánál meggyújtani, mert a robbanás a csövön keresztül visszacsap az edénybe és azt darabokra repeszti. Az oxigén, mint látjátok és a durranásról hallottátok, egyesül a hidrogénnel, még pedig a legnagyobb hevességgel és közben az ereje épp úgy, mint a hidrogén ereje, teljesen felemésztõdik. Úgy mondják, hogy az oxigén és a hidrogén tulajdonságai kölcsönösen neutralizálják, azaz semlegesítik egymást.
Most már feltételezhetem, hogy a víz, az oxigén és az atmoszférikus levegô vegyi természete között levô bensõ kapcsolatot alaposabban ismeritek. Ez a darab kálium, melyet a vízre helyezek, – mint ezt most ismét megteszem – miért bontja meg a vizet? Mert oxigént talál a vízben. És mi szabadul fel közben? A hidrogén szabadul fel, és ez a hidrogén elég, miközben a kálium az oxigénnel egyesül; ez a darab kálium kivonja az oxigént, miközben a vizet felbontja, – tekintsük víznek azt, ami a gyertya elégése alkalmával képzôdik – kivonja, ismétlem, az oxigént a vízbôl éppúgy, mint ahogy a gyertya kivonja azt a levegôbôl és ugyanakkor hidrogén szabadul fel. Az oxigénnek és a káliumnak ez az egymáshoz való szép rokonérzése akkor is mutatkozik, ha egy darab káliumot jégre teszek, – abban a pillanatban, mint Iátjátok, a jég a káliumot lángra Iobbantja.
Mindezeket még ma meg akartam nektek mutatni, hogy e folyamatokról szerzett ismereteitek kibôvüljenek és lássátok, hogy a jelenségek mennyire a körülményektôl függnek. A jég a káliummal való érintkezés kapcsán vulkánikus hatást idéz elô.
Miután ez alkalommal ily szokatlan jelenségeket érintettem, a legközelebbi összejövetelünk alkalmával azt tûzöm ki feladatomul, hogy nektek beigazoljam, hogy nem fenyeget bennünket veszedelem és nem kell félnünk, ha a gyertyának a szobában, vagy a világítógáznak az utcán, a tüzelôanyagnak a konyhában való használata alkalmával mindig figyelembe vesszük azokat a természeti törvényeket, amelyeknek mindezek alá vannak vetve.