Szalai István
Az 1,4-ciklohexándion bromát kénsav oszcilláló reakció vizsgálata
Eötvös Loránd Tudományegyetem, Budapest
1999
Nemkatalizált bromátoszcillátorokon olyan bromátionnal történõ oxidációs reakciókat értünk, amelyek során periodikus viselkedés (koncentráció oszcilláció) figyelhetõ meg katalizátor hozzáadása nélkül is. Általában fenol és anilin származékok használhatók redukálószerként ezekben a reakciókban. A jelenség kialakulásában a brómoxi vegyületek reakcióinak van alapvetõ szerepe, így a dinamikai viselkedést jól leíró vázmodellek adhatók meg a szerves komponensek reakcióinak részletesebb ismerte nélkül is. Az 1,4-ciklohexándion (CHD) az egyetlen olyan nem aromás szerves vegyület, amely szintén alkalmazható redukálószerként. Számos érdekes eltérést mutat ez a reakció az aromás komponenseket tartalmazókhoz képest. Ebben az esetben sem csapadékképzõdés sem buborékképzõdés nem zavarja a jelenségek megfigyelését és anyagáramlás szempontjából zárt rendszerben lényegesen nagyobb számú koncentráció oszcilláció kialakulása figyelhetõ meg. Munkám során a CHD oxidációjának vizsgálatát és ez alapján egy, az oszcillációs viselkedés leírására alkalmas modell kidolgozását tûztem ki célul. (Az ábrákat és az értekezés alapjául szolgáló közlemények jegyzékét lásd az angol nyelvû összefoglalóban.)
A kiindulási összetétel változtatásának
hatását vizsgálva megállapítottam, hogy
periodikus viselkedés a [![]() ]0/[CHD]0
arány egy meghatározott tartományában alakulhat
ki. A reakció indítása elõtt megbrómozva
a CHD-t az oszcillácót megelõzõ szakasz hosszának
jelentõs csökkenését figyeltem meg. Ez azt mutatja,
hogy fontos szerepe van a lassan termelõdõ brómozott
termékeknek.
]0/[CHD]0
arány egy meghatározott tartományában alakulhat
ki. A reakció indítása elõtt megbrómozva
a CHD-t az oszcillácót megelõzõ szakasz hosszának
jelentõs csökkenését figyeltem meg. Ez azt mutatja,
hogy fontos szerepe van a lassan termelõdõ brómozott
termékeknek.
GC/MS módszerrel azonosítottam a CHD bromát reakció néhány közti- és végtermékét. Megállapítottam, hogy a reakció során aromatizálódás történik (1. ábra) és 1,4-benzokinon (Q), 1,4-hidrokinon (H2Q), monobróm-hidrokinon, monobróm-ciklohexándion (BrCHD) és dibróm-ciklohexándion keletkezik. A CHD bróm reakcióban (kénsavas közegben) végtermékként 1,4-hidrokinont keletkezését figyeltem meg. Ez azzal magyarázható, hogy a monobróm-ciklohexándion nem stabil, belõle hidrogén-bromid eliminációval 2-ciklohexén-1,4-dion (CHED) keletkezik, amely savas közegben viszonylag gyorsan 1,4-hidrokinonná alakul.
Spektrofotometriás mérésekbõl nemlineáris paraméter-becsléssel megadtam a CHD brómozása során végbemenõ legfontosabb reakciók sebességi együtthatóját (k11=2,13 (± 0,39· 10-4 mol-1 dm3 s-1 , k14= 5,0 (± 0,91)· 10-5 mol-1 dm3s-1 és k15=1,94 (± 0,256)·10-4 mol-1 dm3 s-1).
CHD + H+![]() CHDE
+ H+ (R 11, -11)
CHDE
+ H+ (R 11, -11)
CHDE + Br2![]() BrCHD + H+ + Br- (R 12)
BrCHD + H+ + Br- (R 12)
BrCHD + H+![]() CHED + Br- + 2 H+ (R 14)
CHED + Br- + 2 H+ (R 14)
CHED + H+![]() H2Q
+ H+ (R 15)
H2Q
+ H+ (R 15)
Megállapítottam, hogy a H2Q bromátion reakció Landolt-típusú reakció. A reakció során termelõdõ brómot eltávolítva autokatalitikus viselkedést figyeltem meg. A spektrofotometriás mérések és a szimulációk összehasonlításából becslést adtam meg a H2Q bróm (3·104 mol-1 dm3 s-1), az H2Q bróm-dioxid-gyök (8·105 mol-1 dm3 s-1), az H2Q bromátion (2·10-2 mol-2 dm6 s-1) és az H2Q hipobrómossav (6·105 mol-1 dm3 s-1) reakciók sebességi együtthatójára.
Eredményeim alapján felállítottam egy 27 reakcióból álló és 15 komponenst tartalmazó modellt, amellyel jól szimulálható az oszcillációs viselkedés (2. ábra) és az oszcillációk leállását követõ redoxipotenciál változás. Elvégeztem a modell érzékenységanalízisét (az algebrai sebességérzékenységi mátrix fõkomponens analízisét használva) és redukcióját. Ennek eredményeként megadtam egy négyváltozós és egy háromváltozós vázmodellt, melyekben kizárólag kísérletileg meghatározott sebességi együtthatók szerepelnek. Mindkét modell jól visszaadja a rendszer dinamikai viselkedését. A háromváltozós modellben a bromidion, a brómossav és a H2Q szerepel változóként:
Br- + HBrO2 + H+![]() 2
HOBr (M 1)
2
HOBr (M 1)
Br- + ![]() +
2
H+
+
2
H+![]() HOBr
+
HBrO2(M 2)
HOBr
+
HBrO2(M 2)
2 HBrO2![]() HOBr
+
HOBr
+ ![]() + H+
(M 3)
+ H+
(M 3)
HBrO2 + H2Q + ![]() +
H+
+
H+![]() 2 HBrO2 + Q + H2O (M 4)
2 HBrO2 + Q + H2O (M 4)
BrCHD![]() CHED +
Br- + H+(M 5)
CHED +
Br- + H+(M 5)
CHED + H+![]() H2Q
+ H+ (M 6)
H2Q
+ H+ (M 6)
H2Q + ![]() +
H+
+
H+![]() Q
+
HBrO2+
H2O (M 7)
Q
+
HBrO2+
H2O (M 7)
A háromváltozós modell stabilitásvizsgálatával megkerestem az oszcilláció kialakulásának feltételeit. Megállapítottam, hogy két fontos paraméter emelhetõ ki:
![]() és
és ![]() .
.
Az elsõ a bromidionok és a hidrokinon termelõdés sebességének aránya, a második az oxidálószer és a redukálószer aránya. Az oszcillációk kialakulásának feltételei:
![]() és m
< m *
és m
< m *
(ahol![]() ,
,![]() és m *» 3,3 mol2× dm-6).
és m *» 3,3 mol2× dm-6).
Összevetettem a CHD bromátion reakcióra felírt vázmodellt az Oregonátor és a Liu-Scott féle, aromás szubsztrátumú nemkatalizált rendszerekre felírt, modellel. Megállapítottam, hogy az oszcilláció szabályozásában ebben a reakcióban a bromidionok mellett jelentõs szerepe van a H2Q-nak is. A CHD bromátion reakció nagy mértékben hasonlít egy folytonosan betáplált reaktorban végbemenõ reakcióhoz. Minden oszcillációs periódushoz újra kell termelõdnie a H2Q-nak, amely közelítõleg állandó sebességgel keletkezik a rendszerben.
Analógiát állapítottam meg az ún.
oszcilláló Landolt-rendszerek (pl. ![]() )
és az általam vizsgált reakció között.
A fõ különbség, hogy ez utóbbiban az egyik
redukálószer (az 1,4-hidrokinon) a reakcióban termelõdik,
míg az elõbbiekben mindkét redukálószert
kívülrõl kell bevinni.
)
és az általam vizsgált reakció között.
A fõ különbség, hogy ez utóbbiban az egyik
redukálószer (az 1,4-hidrokinon) a reakcióban termelõdik,
míg az elõbbiekben mindkét redukálószert
kívülrõl kell bevinni.
Köszönöm témavezetõmnek Dr. Körös Endrének, hogy az általa vezetett kutatásokba bekapcsolódhattam és munkámat mindvégig a legteljesebb mértékben támogatta.
Studies on the 1,4-Cyclohexanedione Bromate Sulfuric Acid Oscillatory System
Ph.D. Thesis, Eötvös L. University
Budapest
1999
Uncatalyzed bromate oscillators, UBOs, (i.e., reacting systems that
exhibit oscillatory dynamics even in the absence of a metal-ion, respectively,
metal-complex catalyst) are composed of an aromatic (mainly a phenol or
an aniline derivative), bromate ion and sulfuric acid. The overall reaction
is the parallel running oxidation and bromination of the organic substrate
that results in a variety of products depending on the chemical composition
of the reacting system. Under batch configuration most UBOs exhibit a few,
highly damped temporal redox-potential and bromide-ion-concentration oscillations.
An alicyclic diketone, the 1,4-cyclohexanedione (CHD) reacts with acidic
bromate in an oscillatory manner, and under optimal chemical conditions
200-300 high frequency oscillations should be recorded. Similar to the
other bromate oscillators, the very special chemistry of bromate ion, that
is, depending upon the actual bromide ion concentration, two-electron (oxygen
transfer) and one-electron processes occur alternately, makes the CHD
bromate acid system oscillatory. Its unusual organic chemistry, however,
deserves special attention.
We followed the temporal course of the reaction by analyzing samples,
withdrawn from the reaction mixture at regular intervals, using GC/MS techniques.
We could identify 1,4-dihydroxybenzene (H2Q) and 1,4-benzoquinone
as well as 2-bromo-1,4-cyclohexanedione (BrCHD), 2-bromo-1,4-dyhidroxybenzene,
and 2-bromo-1,4-benzoquinone. Thus we established that bromate ion in dilute
sulfuric acid did not cleave the alicyclic ring but the first step of oxidation
was an aromatization process (Fig. 1). This fact accounted for the absence
of carbon dioxide evolution during the course of the reaction.
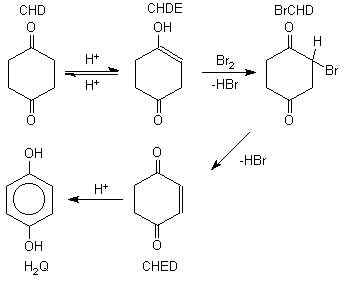
Figure 1. Mechanism of the formation of 1,4-dihydroxybenzene.
The kinetics of H2Q formation, of the reaction of CHD an
Br2, were followed spectrophotometrically. We estimated the
most important rate constants (k11=2.13 (± 0.39·
10-4 mol-1 dm3 s-1
, k14=
5.0 (± 0.91)·10-5 mol-1dm3s-1
and
k15=1.94 (± 0.256)·10-4 mol-1
dm3
s-1).
CHD + H+![]() CHDE
+ H+ (R 11, -11)
CHDE
+ H+ (R 11, -11)
CHDE + Br2![]() BrCHD + H+ + Br- (R 12)
BrCHD + H+ + Br- (R 12)
BrCHD + H+![]() CHED + Br- + 2 H+ (R 14)
CHED + Br- + 2 H+ (R 14)
CHED + H+![]() H2Q
+ H+ (R 15)
H2Q
+ H+ (R 15)
The reaction between H2Q and bromate ion exhibited Landolt (clock)-type dynamics. Upon the comparison of the experimental data and simulations, we suggested the rate constants of the reaction of H2Q with bromine (3· 104 mol-1dm3 s-1), BrO2× (8·105 mol-1 dm3 s-1), bromate ion (2· 10-2 mol-2 dm6×s-1), and HOBr (6·105 mol-1 dm3×s-1).
On the basis our analytical and kinetic investigations a detailed mechanistic model (27-reaction and 15-species) has been suggested that could well simulate the temporal oscillations (Fig. 2).

Figure 2. Oscillations during the bromate CHD reaction. Experimental
conditions: [CHD]0=0.10 mol dm-3, [NaBrO3]0=0.10
mol×dm-3, [H2SO4]0=1.0
mol dm-3, 20o C.
(a) Measured redox potential. (b) Simulation.
Both the important reactions and major interactions are identified using principal component analysis. These considerations result in a 21-reaction, 14-species reduced mechanism that reproduces the behavior of the original model. This model further simplified to a three-variable (H2Q, Br-, HBrO2) skeleton model that differs from the Oregonator. It is shown that the CHD bromate reacting system is closely related dynamically to the ½emptying / refilling½ CSTR oscillators.
Br- + HBrO2 + H+![]() 2
HOBr (M 1)
2
HOBr (M 1)
Br- + ![]() +
2
H+
+
2
H+![]() HOBr
+
HBrO2(M 2)
HOBr
+
HBrO2(M 2)
2 HBrO2![]() HOBr
+
HOBr
+ ![]() + H+
(M 3)
+ H+
(M 3)
HBrO2 + H2Q + ![]() +
H+
+
H+![]() 2 HBrO2 + Q + H2O (M 4)
2 HBrO2 + Q + H2O (M 4)
BrCHD![]() CHED +
Br- + H+(M 5)
CHED +
Br- + H+(M 5)
CHED + H+![]() H2Q
+ H+ (M 6)
H2Q
+ H+ (M 6)
H2Q + ![]() +
H+
+
H+![]() Q
+
HBrO2+
H2O (M 7)
Q
+
HBrO2+
H2O (M 7)
By stability analysis of the three-variable model we could identify the parametric conditions of the oscillations. We may conclude there are two important parameters:
![]() and
and ![]()
(the ratio of production of H2Q and Br-). Oscillations can occur in the system if
![]() and m <
m *
and m <
m *
(where![]() ,
,![]() and m *» 3.3 mol2× dm-6).
and m *» 3.3 mol2× dm-6).
Considering the mechanism of the CHD bromate reacting system it can be concluded that it is closely related to many CSTR oscillators. Most CSTR oscillators are not self - contained, that is they do not oscillate without the CSTR flow. They are "emptying / refilling" oscillators. The reactor fills with some substrate until eventually an autocatalytic reaction is triggered, which rapidly consumes essentially all of that substrate. The system is then quiescent while being reinitialized and refilled with another pulse. Our analysis shows that this is indeed the case in the CHD bromate oscillator. The autocatalytic substrate is H2Q that is steadily produced by the oxidation of CHD by bromate. It thus accumulates until eventually suddenly and autocatalytically oxidized to Q by bromate. The system is then quiescent until sufficient H2Q accumulates for another pulse. Bromide ion does not appear to be dynamically critical to the appearance of oscillations, although it may well mediate the system quantitatively.
Notwithstanding that the CHD bromate system is a bromate - driven oscillator it is dynamically quite different from classic system represented by the Oregonator.
We pointed to the relation that may exist between the CHD bromate
acid system and those reported as oscillatory Landolt-type reactions
[e.g., ![]() ].
A major difference between the previously reported Landolt-type (oligo)oscillators
and the CHD bromate acid system is that in the latter one of the reducing
agents (H2Q) is generated during the reaction, in the
former one, however, both reductants should be present at the start of
the reaction.
].
A major difference between the previously reported Landolt-type (oligo)oscillators
and the CHD bromate acid system is that in the latter one of the reducing
agents (H2Q) is generated during the reaction, in the
former one, however, both reductants should be present at the start of
the reaction.
Publications
K. Kurin-Csörgei, I. Szalai, I. Molnár-Perl, E. Kõrös:
The 1,4-Cyclohexanedione-Bromate-Acid Oscillatory System I. Its Organic Chemistry
React. Kinet. Catal. Lett. 53 (1994) 115.K. Kurin-Csörgei, I. Szalai, E. Kõrös: The 1,4-Cyclohexanedione-Bromate-Acid Oscillatory System II. Chemical Waves
React. Kinet. Catal. Lett. 54 (1995) 217.I. Molnár-Perl, S. Tisza, E. Kõrös, K. Kurin-Csörgei, I. Szalai: GC/MS Quantitation of Hydroquinone, 1,4-Benzoquinone, and 1,4-Cyclohexanedione: One by One and Simultaneously
J. High Resol. Chromatogr. 18 (1995) 749.Szalai, I., Kõrös, E.:
The 1,4-Cyclohexanedione-Bromate-Acid Oscillatory System 3. Detailed Mechanism
J. Phys. Chem. 102 (1998) 6892.Szalai, I., Kõrös, E., Györgyi, L.:
The 1,4-Cyclohexanedione-Bromate-Acid Oscillatory System 4. Reduced Models
J. Phys. Chem. 103 (1999) 243.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |