
Szalay Roland
N-Karbonsav trimetilszilil-észterek elõállítása és szolvolíziskinetikai vizsgálata
Eötvös Loránd Tudományegyetem, Budapest
1996
Eredmények összefoglalása
Az alábbi, trimetilszilil-karbamidát típusú származékokat állítottam elõ:
PhN(R)COOSiMe3, R = Me, Et, n-Pr, n-Bu, i-Pr, t-Bu, ill. QCOOSiMe3, Q =

A 10 új vegyületen kívül az N-metil-anilin és a pirrolidin megfelelõ származékát az irodalomban közölt módszertõl eltérõen készítettem el.
A csökkent nukleofilitású nitrogént tartalmazó kiindulási vegyületek (a pirrolidin és az indolin kivételével valamennyi) karboxi-szililezésére új eljárást dolgoztam ki, pl.:
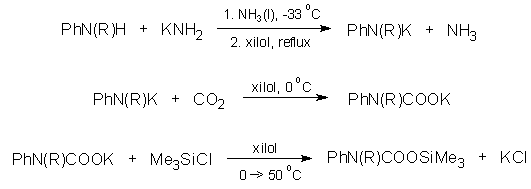
A vegyületek IR-spektrumában az amid-I sávok különbözõ frekvenciáiból a karbamidát-egység eltérõ konjugációs viszonyaira következtettem.
A 1H-NMR-spektrumok alapján megállapítottam, hogy az N-alkil-N-fenil-származékok sorozatán belül a láncelágazások számának növekedésével a Me3Si-protonok árnyékoltsága növekszik.
A szililészterek és a kiindulási vegyületek UV-spektrumait illetõen összehasonlító vizsgálatokat folytattam. Az N-fenil- (ill. indolin-) származékoknál értelmeztem az 1La-sávhoz tartozó hullámhossz-, ill. intenzitás-maximumok és a szubsztituensek hatása közötti kapcsolatot. Megállapítottam, hogy a nitrogénen levõ R-csoport növekvõ térigénye a sáv-maximumok hipszokróm eltolódását, ill. hipokróm effektusát eredményezi. A n-hexán, ill. az acetonitril oldószerekben felvett spektrumok alapján a sávok oldószerfüggését hasonlóan ¾ sztérikus okokkal ¾ magyaráztam.
A szililészterek szolvolíziskinetikáját izopropil-alkohol-dioxán elegyekben UV-spektrofotométerrel, ill. gázkromatográffal tanulmányoztam. A vegyületek alkohollal az alábbi séma szerint reagálnak:

A heteroaromás származékoknál a képzõdött N-karbonsav számottevõ stabilitással rendelkezik, míg a többi vegyület esetében azonnal elbomlik a megfelelõ aminra és szén-dioxidra.
Vizsgáltam az izotópeffektust, valamint a hõmérsékletnek és a különféle adalékoknak (lítium-klorid, dietil-amin, tri-etil-amin, ill. -hidroklorid, nátrium-izopropoxid, ill. -hidroxid) a reakciósebességre gyakorolt hatását.
A pirrolidin-származéknak a többi vegyülettõl eltérõ kinetikai viselkedését a szolvolízis során képzõdõ pirrolidin autokatalitikus hatásával magyaráztam.
Megállapítottam, hogy a sebességi állandók növekednek a reakcióelegy növekvõ LiCl-koncentrációjával. Ebbõl arra következtettem, hogy az átalakulások poláris átmeneti állapoton keresztül mennek végbe.
Az N-fenil-származékok O-deutero-izopropil-alkoholos szolvolízisénél észlelt szekunder kinetikus (oldószer)-izotópeffektus alapján megállapítottam, hogy a protoncsere nem lehet a folyamat sebességmeghatározó, ill. ezt megelõzõ lépése ¾ nagyságrendje ugyanakkor megfelel az alkohol-molekula sebességmeghatározó nukleofil támadásának a reakciócentrumon (Si-atom).
Az aktiválási entrópiák (DS‡) negatív értékeibõl a reakciók asszociatív mechanizmusára következtettem.
Megállapítottam, hogy az N-n-alkil-N-fenil-származékok sorozatán belül izokinetikus összefüggés van az aktiválási paraméterek (DH‡ és DS‡) között, míg a Me, Et, i-Pr, t-Bu sorban a reaktivitás (ill. DG‡) változását az entalpikus tag (DH‡) változása határozza meg.
Az N-metil-N-fenil-karbamidsav szililészter szolvolízi-sénél báziskatalízist tapasztaltam, melybõl arra következtettem, hogy a közeg protonmegkötõ-képességének szerepe van a bruttó folyamatban.
A kinetikai vizsgálatok eredményeinek alapján a szililészterek szolvolízisére az alábbi, SN2-Si típusú mechanizmust javasoltam:

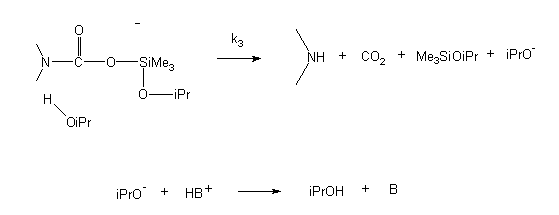
k1 << k-1, k1 < k2 << k3
Sok esetben összefüggést találtam a vegyületek szerkezete, spektroszkópiai, ill. szolvolíziskinetikai tulajdonságai között.
Preparation and solvolysis kinetics of N-carboxylic acid trimethylsilyl esters
Ph.D. thesis, Eötvös Loránd University, Budapest
1996
Preparations (see figures in the Hungarian text)
New O-trimethylsilyl carbamic acid derivatives were prepared from the following ten compounds: pyrrole, indole, indoline, carbazole, diphenylamine, N-ethyl-, -n-propyl-, -n-butyl-, -isopropyl- and -tert.-butylaniline.
Further two derivatives of the pyrrolidine and of the N-methylaniline, respectively, were also prepared by methods different from those described earlier in the literature.
New synthetic method was developed to carboxy-silylate compounds having nitrogen with reduced nucleophilicity.
Spectroscopy
The different extent of the conjugation of the amide bonds was deduced from the values of the amide-I frequencies in the IR spectra of compounds.
The 1H-NMR spectra of the N-alkyl-N-phenyl derivatives revealed that the increasing branching of the alkyl group results in the increasing shielding of the silyl protons.
The UV spectra of the silyl esters and of the starting compounds, respectively, were compared. Within the series of the N-phenyl derivatives the relationship between the data of the 1La band and the effects of the substituents was interpreted. It was pointed out that the increasing bulkiness of the R-group attached to nitrogen result in the blue shift and the hypochromic effect of the band maxima. The solvent-dependence was similarly explained by steric reasons.
Kinetics
The solvolysis kinetics of the silyl esters were studied in isopropanol-dioxane mixtures. The reactions (see fig. in the Hungarian text) were monitored by UV spectrophotometry and by gas chromatography, respectively. In the heteroaromatic series the N-carboxylic acid formed as product is stable while in the other cases the acid immediately decomposes to the corresponding amine and carbon-dioxide.
The solvent isotopic effect and the dependence of rates on the ionic strength (LiCl), on the temperature and on the concentration of various additives (sodium isopropoxide, sodium hydroxide, diethylamine, triethylamine and its hydrochloride, respectively) were also studied.
The kinetic behaviour of the pyrrolidine derivative different from that of the other compounds was explained with the autocatalytic character of the pyrrolidine formed during the solvolysis.
As the rate constants were increasing with the increasing LiCl concentration of the medium, a transition state of polar character formed in the reaction.
In the solvolysis of the N-phenyl derivative with O-deuterioisopropanol the secondary kinetic (solvent) isotope effect showed that the proton transfer does not seem to take place in the rate determining (or in a previous) step, however, its value corresponds to the rate determining nucleophilic attack of the alcohol on the reaction center (Si-atom).
The negative values of the activation entropy (DS‡) are in accordance to an associative mechanism.
In the series of the N-n-alkyl-N-phenyl derivatives an isokinetic relationship was observed between the activation parameters (DH‡ and DS‡) while in the Me, Et, i-Pr, t-Bu series the change in the reactivity (or in the DG‡ values) is directed by the change of the enthalpies (DH‡).
The solvolyis of the N-methyl-N-phenyl-carbamic acid silyl ester is catalysed by bases hence the proton capture ability of the medium plays role in the overall reaction.
A mechanism of SN2-Si was suggested upon the results (see fig. in the Hungarian text).
In many cases interdependence was observed between the structure, the spectroscopic and the kinetic behaviour of compounds.
Publications
1. Szalay Roland, Knausz Dezsõ, Szakács László, Újszászy Kálmán, Csákvári Béla: Trimetilszilil-karbamidátok elôállítása nitrogéntartalmú heterociklusos vegyületekbõl, valamint szolvolízisük vizsgálata Kémiai Közlemények, 74 (1992) 131-137
2. R. Szalay, D. Knausz, L. Szakács, K. Újszászy, P. Sohár: Preparation and solvolysis of trimethylsilyl N-alkyl-N-phenyl-carbamates J. Organomet. Chem., 487 (1995) 267-271
3. R. Szalay, D. Knausz, L. Szakács, K. Újszászy, B. Csákvári, P. Sohár: Solvolysis kinetics of trimethyl-silyl esters of aromatic N-carboxylic acids J. Organomet. Chem., 493 (1995) 267-270
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |