

Kapillerné Dezsõfi Rita
Fluorvegyületek térszerkezet meghatározása téren át ható csatolások alapján
Eötvös Loránd Tudományegyetem, Budapest
1997
Gyógyszervegyületek nagymûszeres szerkezetvizsgálatához hozzátartozik a vegyületek oldatbeli szerkezetének, térszerkezetének meghatározása, ennek egyik legalkalmasabb vizsgálati módszere az NMR spektroszkópia. Az NMR mérések egyik alap paramétere a csatolási állandó.
| R | |
| 1a | p-OCH3 |
| 1b | p-OCH3 |
| 2a | p-OCH2OCH3 |
| 2b | p-OCH2OCH3 |
| 3 | p-OH |
| 4 | p-OCH2CH3 |
| 5 | p-OCH2CH2OH |
| 6 | p-OCH2CH2Cl |
| 7 | p-OCH2CH2OCH2OCH3 |
| 8 | p-OCH2CH2OCH2Ph |
| 9 | p-OCH2CH(OCH2CH3)2 |
| 10 | p-OCH2CH2N(CH3)2 |
| 11 | p-OCH2CH2N(CH2Ph)CH2CH2OCH2Ph |
| 12 | o-OCH2CH2Cl |
Triaril-etanol származékok vizsgálata során a molekuláknál 5J(F,H) távolható csatolásokat észleltem a CF3 csoport és az OH csoport, illetve a CF3 csoporttal geminális fenilgyûrû orto-hidrogénjei között.
Diasztereomer párok összehasonlító vizsgálata alapján meghatároztam mindkét diasztereomer konfigurációját és legvalószínûbb konformerjét. Megállapítottam, hogy a spektroszkópiai jellegzetességek alapján pár nélküli diasztereomerek konfigurációja és konformációja is meghatározható.
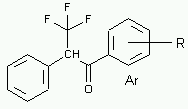
Az aromás magban szubsztituált a-fenil-a-trifluormetil-acetofenon származékok spektrumának vizsgálatával kimutattam, hogy téren át ható csatolás van a CF3 csoport fluoratomjai és a fenilgyûrû orto-hidrogénjei között, 14-16.


A triaril szubsztituált etilén származékoknál is észleltem az 5J(F,H) téren át ható csatolást a CF3 csoport és a geminális fenilgyûrû orto-hidrogénjei között és meghatároztam a csatolási állandót 5J(F,H). 13C-NMR mérések alapján meghatároztam a kötések által közvetített 2J(F,C) és 3J(F,C) csatolásokat és a téren át ható 4J(F,C) csatolást, 17-20.
 |
R | R |  |
||
| 14 | o-OH | 17 | o-O-CH2-CH2-Cl(Z) | ||
| 15 | p-CH3 | 18 | o-O-CH2-CH2-Cl(E) | ||
| 16 | p-CH2-CH2-Cl | 19 | p-O-CH2-CH2-Cl(E) | ||
| 20 | p-O-CH2-CH2-OH(E) |
A HyperChem programmal végzett molekula-mechanikai számításokkal meghatároztam a legkedvezõbb térszerkezetet a 2b vegyület esetében és ennek alapján a három nyitott állású konformer szerkezetét. A kapott szerkezeti adatokkal alátámasztottam a spektrumok alapján a legkedvezõbbnek feltételezett konformer szerkezetet. Megállapítottam, hogy a kísérleti 1H-NMR spektrumban azon atomok között lehet F-H téren át ható csatolást észlelni, amelyek elméletileg kiszámított távolsága nem nagyobb, mint a van der Waals sugarak összege.
A 4,6,dimetoxi-1-metil-4-triflourometil-3,4-dihidro-izokinolin két stabilis konformerjéhez tartozó elméletileg szerkesztett 1H-NMR spektrumok közül a spektrum alapján általam preferáltnak feltételezett a konformer elméleti spektruma egyezik jobban a kísérleti spektrummal, igazolva a konformer szerkezetre vonatkozó következtetésem helytállóságát.
Determination the stereostructure of compounds containig fluorine atoms by through space couplings
Ph.D. thesis, Eötvös Loránd University,
Budapest
1997
| R | |
| 1a | p-OCH3 |
| 1b | p-OCH3 |
| 2a | p-OCH2OCH3 |
| 2b | p-OCH2OCH3 |
| 3 | p-OH |
| 4 | p-OCH2CH3 |
| 5 | p-OCH2CH2OH |
| 6 | p-OCH2CH2Cl |
| 7 | p-OCH2CH2OCH2OCH3 |
| 8 | p-OCH2CH2OCH2Ph |
| 9 | p-OCH2CH(OCH2CH3)2 |
| 10 | p-OCH2CH2N(CH3)2 |
| 11 | p-OCH2CH2N(CH2Ph)CH2CH2OCH2Ph |
| 12 | o-OCH2CH2Cl |
Long range and through space couplings in fluorine substituted organic modellcompounds were studied. I carried out a comparative study of diastrereomer pairs of derivatives of triaryl substituted ethanes 1-13. CF3-OH and CF3-H(ortho- phenyl)-type long range couplings were observed in the 1H-NMR spectrum. For compounds with 1R*,2S* configuration the signals of the AA'XX' spinsystem of aromatic protons on the para-substituted benzyl ring are upfield shifted. This can't be found with the 1R*,2R* diastereomers, but the phenyl hydrogens are more shielded. On the basis of above mentioned observations can be determined the preferred
conformation. By comparative examination of diastereomeric pairs can be determined the configuration and the preferred conformation also for derivatives of triaryl substituted ethanes. The data of the preferred stereostructures determined by molecule-mechanical calculations supports the supposed conformers. It can be stated there are F-H trough space couplings between those atoms whose distances are near to the sum of their van der Waals radii. The 13C-NMR measurements are in accordance with the the conclusions based on the 1H-NMR spectrum. The conformations of the examined compounds are independent of the solvent. Hindered rotation was stated for 1-trifluormethyl-2-hydroxi-1,2-diphenyl-2-ortho-kloretoxi-phenyl-ethan. The coalescencie temperature Tc is 295 K. The free enthalpie calculated from Tc is 50.9 KJ/mol.


I measured the precursors of these compounds, the in aromatic ring substituted a-phenyl-a-trifluormethyl acetofenon derivatives, too 14-16. For these compounds the F-H trough space couplings are also detectable, between the CF3 group and the ortho-hydrogens of the phenyl ring. The same interaction imposes at the derivatives of the triaryl substituted ethenes 17-20. Based on the 13C-NMR spectra of these compounds trough space couplings between the CF3 group and the ortho-carbon of the geminal phenyl ring can be determined.
 |
R | R |  |
||
| 14 | o-OH | 17 | o-O-CH2-CH2-Cl(Z) | ||
| 15 | p-CH3 | 18 | o-O-CH2-CH2-Cl(E) | ||
| 16 | p-CH2-CH2-Cl | 19 | p-O-CH2-CH2-Cl(E) | ||
| 20 | p-O-CH2-CH2-OH(E) |
My examinations demonstrate, that though the long range and the trough space couplings hardly influence the NMR spectra, but their observation and their magnitude compared to each other give important and sensitive information about the stereostructure.
Publications
1. G. Németh, R. Kapiller-Dezsõfi, Gy. Lax and Gy. Simig: New Practical Synthesis of Panomifene. The Effect of 2-Trifluoromethyl Substituent on the Stereoselectivity of Dehydration of 1,1,2-Triarylethanols. Tetrahedron, 52 (39) (1996) 12821-12830.
2. R. Kapiller-Dezsõfi, G . Németh, Gy. Lax, Gy. Simig and P. Sohár: Conformation analysis of intermediates of Tamoxifen. J. Mol. Struct., 441 (1998) 89-92.
3. I.Kövesdi, R. Kapiller Dezsõfi: 1H and 13C NMR analysis of nifedipin. Acta Pharmacuticals Hungarica, 66 (1996) 11-14.
| Vissza a tartalomjegyzékhez Back to Contents |
Vissza a PhD-tézisek tartalomjegyzékhez Back to PhD theses list |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |