
1. ábra. A gélelõállítás folyamata
Mezei Rita
Organikus közegben elõállított alumínium-oxid-hidroxid tartalmú gélek kémiai és szerkezeti vizsgálata
Eötvös Loránd Tudományegyetem, Budapest
1998
Tudományos háttér
Az ún. szol-gél módszer a hagyományosnál
alacsonyabb hõmérsékleten végrehajtható
utat kínál kerámiák és üvegek elõállítására.
Alapelve, hogy a fém-oxigén kötéseket, illetve
azok prekurzoraiként a fém-hidroxid kötéseket,
oldatfázisban hozzák létre, gélt állítanak
elõ. Az oldószert az olvasztásnál jóval
alacsonyabb hõmérsékletû hõkezeléssel
távolítják el. A szol-gél módszer felhasználhatóságát,
jelentõségét egyrészt az adja meg, hogy a gélbõl
könnyen nyerhetõ megfelelõ formájú (tömb,
film, szál, por) termék. Továbbá lehetõséget
ad a kerámia vagy üveg kémiai összetételének
és mikroszerkezetének megtervezett kialakítására,
a szintetikus prekurzorok használata pedig igen nagy tisztaságot
eredményez. A kapott termék tulajdonságát a
gélfázisban kialakuló szerkezet határozza meg,
ezért a módszer alapkutatásában nagy fontosságú
a gélek vizsgálata.
Célkitûzés
Kutatási munkánk távlati célja kémiailag
tiszta alumínium-oxid szálak illetve tömbök szol-gél
elõállítása. Ennek elsõ lépéseként
alumínium-oxid-hidroxid tartalmú szálhúzásra
alkalmas elegy illetve transzparens tömbszerû gél készítése
és jellemzése volt a doktori munkám feladata. Alumínium-oxid-hidroxid
gélek elõállítására alapvetõen
két módszer ismeretes: A vízzel gyorsan reagáló
alumínium-alkoholátokból kiindulva üvegszerû,
átlátszó monolit gélt lehet kapni. A módszer
szálasítható anyag készítésére
azonban nem elõnyös a nehezen kézben tartható,
túl gyors hidrolízisfolyamat miatt. Ennek során böhmit
(g-AlOOH) csapadék keletkezik, amibõl
idõigényes peptizációval elõbb szolt,
majd az oldószer elpárologtatásával gélt
állítanak elõ. További hátrány
a kiindulási anyag magas ára. Szervetlen alumínium-sók
vizes oldatának pH-ját bázikus reagenssel növelve
szolkészítés után vagy közvetlenül
kapható gél. A szervetlen sók hátránya,
hogy az elõállított gélek általában
nem átlátszóak és nagy mennyiségû
anion épül be a gélbe, ami hevítéssel
sem távolítható el teljesen. Az említett problémák
miatt az alkalmazottaktól teljesen eltérõ újszerû
gélelõállítási módszert kellett
kidolgozni. Irodalmi utalások és az elõkísérletek
szerint Al(NO3)3· 9H2O 1-propanollal
és vízzel készült oldatát hosszabb ideig
magasabb hõmérsékleten kezelve hidrolízis játszódik
le. Jelen munka szûkebb célkitûzése egyrészt
az volt, hogy ennek a teljesen újszerû hidrolízismódnak
felhasználásával gélszerû termékek
elõállítási lehetõségeit dolgozzam
ki. Ezután részletesen vizsgáltam a lejátszódó
kémiai folyamatokat, és a kapott termékeket kémiai
összetétel, kötésrendszer, és szupramolekuláris
szerkezet szempontjából jellemeztem.
Felhasznált vizsgálati módszerek
Az elõállított termékek mennyiségi kémiai analízisét klasszikus és mûszeres módszerekkel és mikroelemanalízissel végeztük. A szerves anyag tartalom minõségi analízise gázkromatográfiás, atmoszférikus nyomású kémiai (APCI), és electrospray (ES) ionizációs tandem-tömegspektrometriás módszerekkel, valamint UV-VIS spektroszkópiával történt. A kialakult kémia kötésrendszer vizsgálatára szilárd fázisú (MAS) 27Al mágneses magrezonancia méréseket (NMR) folytattunk. Ezek mellett infravörös spektroszkópiás, kalorimetriás (DSC) és termogravimetria-tömegspektrometriás (TG-MS) vizsgálatok is történtek. A szupramolekuláris szerkezet meghatározásához kis- és közepesszögû röntgen- és neutron szórási görbéket vettünk fel (SAXS, SANS).

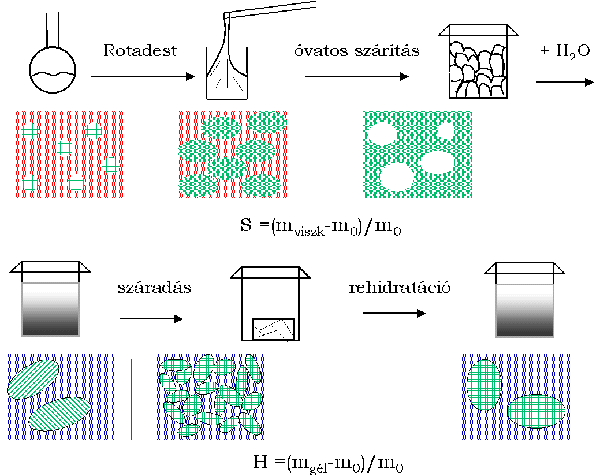
1. ábra. A gélelõállítás folyamata
Kutatási eredmények
Al(NO3)3·9H2O-t 1-propanollal reagáltatva közvetlenül, az idõigényes szolkészítés és peptizáció kiküszöbölésével, kitûnõen szálasítható nagy viszkozitású elegyet, és ennek további feldolgozásával átlátszó, tömbkerámiák készítésére alkalmas, monolit, elasztikus gélt illetve üvegszerû xerogélt állítottam elõ (1.ábra). Az elõállítási folyamat során a nitráttartalom 70%-a eltávozik, ezért ennél a módszernél nincs szükség külön mosási lépés beiktatására. Meghatároztam az elõállítás optimális körülményeit (reakció hõmérséklete, ideje, a reakcióelegy összetétele, az oldószerfelesleg eltávolításának módja), melyek mellett a legkisebb nitrát/ /Al(III) mólarány érhetõ el, csapadék kiválása nélkül. Az 1. táblázat tartalmazza a termékek kémai összetételét.
1. táblázat
A termékek kémiai összetétele
| Moláris összetétel | Relatív tömeg | |||||
| Al | N | C | H | O | (%) | |
| reakcióelegy | 1.0 | 3.0 | 13.5 | 54 | 22.5 | 100 |
| szálasítható elegy | 1.0 | 1.2 | 2.6 | 15.5 | 13.8 | 40 |
| szilárd hab | 1.0 | 0.85 | 0.82 | 7.9 | 8.8 | 28 |
Különbözõ összetételû reakcióelegyek vizsgálatával igazoltam, hogy ebben, az irodalomban alkalmazottaktól lényegesen eltérõ, bázikus reagens kizárásával megvalósított gélelõállítási módszerben, a propanol elsõdleges szerepe, hogy a közeg polaritását csökkentve elõsegíti a nitrátion protonfelvételét. A keletkezõ salétromsav a magasabb hõmérsékleten elbomlik, ami még inkább az asszociáció felé tolja el az egyensúlyt. A rendszer savasságának csökkenése teszi lehetõvé az Al(III)ionok hidrolízisét és kondenzációját.
GC-MS illetve tandem MS mérésekkel igazoltam, hogy az 1-propanol és a nitrátionokból keletkezõ salétromsav, illetve bomlástermékei reakcióba is lépnek egymással, és a propanol észteresített de nagyobb mennyiségben oxidált származékai keletkeznek. Az oxidáció elõször az 1-es majd a 2-es szénatomon következik be, ezután pedig láncszakadás történik és ecetsav illetve hangyasav is keletkezik (2. ábra) Mivel az electrospray ionizációs MS mérésekkel, amely fémkomplexek kimutatására is alkalmas, csak acetát tartalmú komplex volt azonosítható, ezért a legfontosabb terméknek ecetsavat tekintettem. Félkvantitatív kiértékelés alapján kimutattam, hogy a nitrátionok túlnyomó része a propanollal való reakció során távozik a rendszerbõl.

2. ábra. Kémiai reakciók
A kötésrendszer vizsgálatával (szilárd fázisú Al-NMR, IR és XRD ill. TG-MS) igazoltam, hogy az irodalomban elõforduló gélelõállítási módszerekkel ellentétben, a kapott Al-oxid-hidroxid tartalmú termékekben nem alakul ki böhmit vagy böhmitszerû szerkezet. A jól szálasítható, viszkózus elegyben (a nagy szerves anyag tartalom, illetve az alacsony víztartalom miatt) az Al(III)ionok túlnyomóan szerves vegyületeken (fõleg acetáton) keresztül létrejövõ koordinációs kötésekkel kapcsolódnak egymáshoz. A víz hatására képzõdõ hidrogélekben több mint 85%-ban OH-, O- és acetátionokkal egymáshoz kapcsolódó oktaéderesen koordinált Al(III)-ionokat mutattunk ki.
Acetát ionok többféle módon koordinálódhatnak az Al (III) köré (3. ábra). Ezek közül irodalmi adatok és a saját mérések alapján is a kétfogú hídligandumként való koordináció a legvalószínûbb. Az acetát ionoknak nagy jelentõsége van abban, hogy stabil, gélszerû termékek állíthatóak elõ. A koordinációs helyek bizonyos hányadát blokkolják, ezzel akadályozzák meg oxid-hidroxid csapadék keletkezését a hidrolízis folyamat során. A szerves anionok koordinációjának szerepe van mind a szálasítható elegy, mind a monolit gél szerkezetének felépítésében is.

3. ábra. Acetát ionok koordinációja
A szórásvizsgálatok (elsõsorban röntgen-mérések) alapján javaslatot tettem a termékek szupramolekuláris szerkezetére. A 4. ábrán tüntettem fel a felállított szerkezeti modelleket, ahol az Al-ban gazdag tartományokat (aggregátumokat) ábrázoltam, mivel a röntgen-mérésekkel ezekrõl kaphatunk információt. A hidrolízis során. kb. 20 Å átmérõjû izometrikus részecskék alakulnak ki. Az oldószerfelesleg elpárologtatásakor, ami makroszkópikusan a viszkozitás nagymértékû megnövekedésével jár együtt, gyakorlatilag folytonos, laza térháló keletkezik, melyre kvázi rendezettség jellemzõ. További szárítás során a 8 - 50 Å -ös mérettartományban a szerkezet nem változik, azonban nagyobb méretû (200 - 300 Å-ös) inhomogenitások keletkeznek, amelyeket a további kémiai reakciók során fejlõdõ gáznemû termékek által képzett pórusokként azonosítottam.
4. ábra. A szupramolekuláris szerkezet modelljei
A magas víztartalmú hidrogélekben nagy méretû részecskék vannak jelen, melyek miatt a gél opaleszkál. Ezeket a több vízligandumot tartalmazó, hengeres szimmetriájú oligomerek építik fel. A hidrogélek száradása során azonban, bizonyos víztartalom alatt, tömörebb, nagyobb rendezettségû aggregátumok képzõdnek. A xerogél rehidratációjával (vízzel ismét hidrogélt készítve) bizonyítottam, hogy az említett rendezettebb szerkezetû aggregátumok kialakulása irreverzibilis. Ezek az egységek H kötéseken keresztül összekapcsolódva hozzák létre az elasztikus gél szerkezetét. Å viszonylag rendezett módón elhelyezkedõ, néhány száz Å méretû aggregátumok között kisebb pórusok mutathatóak ki, melyek nagysága a gél víztartalmától függ.
Aluminium-oxo-hydroxide gels prepared in organic medium – chemical
and structural studies
Ph.D. Thesis, Eötvös Loránd University Budapest
1998
Scientific background
The so-called sol-gel method provides an alternative, lower temperature
route to the traditional melting process to produce ceramics and glasses.
Its basic principle, that the metal-oxygen or the metal-hydroxide bonds
are to form in solution or in gel phase. After that the solvent is removed
by a heat treatment at much lower temperature than melting. The significance
of sol-gel method is given by the fact that products with various forms
(bulk, film, fibre and powder) can be obtained from gels. Moreover it allows
designing the chemical composition as well as the microstructure of the
ceramic and glass and using synthetic precursors high chemical purity can
be achieved. As the properties of the product are determined by the gel-structure,
the investigation of it is of great importance in the sol-gel science.
Aims
The future prospect of our work is to produce pure Alox fibres and bulk
ceramics. My research problem was to establish a simple method to prepare
a spinnable material as well as a bulk gel, and characterise them. Two
different methods are known to prepare Al-oxo-hydroxide gels. From costly
alkoxides transparent bulk gel can be obtained. However this method is
not applicable for fibre production as the hydrolysis process is difficult
to control. During hydrolysis boehmite (g -AlOOH) precipitates from which
sol is prepared by peptisation, after that gel forms by evaporating the
solvent. From the solution of the cheaper inorganic salts gel can be prepared
directly or through a sol stage by increasing the pH in the system. The
main disadvantage of the method is the large amount of anion incorporated
in the gel structure, which is difficult to remove, even by heat treatment.
Furthermore the gel products are generally not transparent. Due to the
above difficulties a completely new method is to be developed. On the basis
of preliminary experiments and some data in the literature, by heating
the solution of Al(NO3)3· 9H2O
in 1-propanol hydrolysis takes place, and highly viscous, spinnable material
can be formed. The present work aims to work out the method for producing
gel like materials using this new hydrolysis process. Above this the chemical
processes were investigated, and the products was characterised in respect
of chemical composition, bonding, and supramolecular structure.
Experimental methods
Classical and instrumental methods as well as microelemental analysis were performed as the chemical analysis of products. The organic compounds present in the products were qualitatively investigated by gaschromatography as well as atmospheric pressure chemical (APCI) and electrospray ionisation tandem mass spectrometry, moreover UV-VIS spectroscopy. The chemical surroundings of Al ion were analysed by solid state nuclear magnetic resonance spectroscopy (27 Al MAS NMR). Besides experiments by infrared spectroscopy, calorimetry (DSC) and termogravimety (TG-MS) were also performed. To study the supramolecular structure, small and medium angle X-ray as well as neutron scattering curves were recorded (SAXS, SANS).

Figure 1. Gel-preparation process
Results
By reacting Al(NO3)3·9H2O with 1-propanol excellently spinnable material as well as bulk elastic gel and xerogel were produced directly without time-consuming sol preparation and peptisation step (Fig 1.). During the preparation process the 70% of the nitrate ions is removed, thus a washing step is not needed. I determined the optimal parameters (time and temperature of the reaction, the composition of the reaction mixture, the drying method) to obtain the smallest nitrate/Al(III) mole ratio without precipitation. Table 1 contains the chemical composition of the products.
Table 1.
Chemical composition of the products
| Molar composition | Relative mass | |||||
| Al | N | C | H | O | (%) | |
| reaction mixture | 1.0 | 3.0 | 13.5 | 54 | 22.5 | 100 |
| spinnable material | 1.0 | 1.2 | 2.6 | 15.5 | 13.8 | 40 |
| solid foam | 1.0 | 0.85 | 0.82 | 7.9 | 8.8 | 28 |
I proved the main role of propanol in this new, not commonly used hydrolysis process taking place without any basic agent. Namely by decreasing the polarity of the medium it promotes the association of nitric acid, which decomposes at higher temperature. The decreasing acidity allows the hydrolysis and condensation of Al(III) ions.
GC-MS and tandem MS experiments proved that the propanol and the nitric acid or its decomposition products react with each other and esters as well as oxidised derivatives of propanol form. The oxidation process takes place first at C(1), after that at C(2), finally it causes chain shortening accompanied by formation of acetic and formic acid (Fig 2). Acetic acid can be regarded as the main product of these processes, since in MS spectra obtained after electrospray ionisation, which is convenient for observing even metal complexes, only acetate containing Al -complexes can be unambiguously identified. I proved by semi-quantitative calculation that the main part of nitrate ions removes from the system through reaction with propanol.

Figure 2. Chemical processes
Investigating the chemical bonds of Al ions I proved that by this hydrolysis process, boehmit or boehmit-like structure do not form in contrast to the other, wide-spread methods. In the spinnable viscous material (due to the high amount of organic and low amount of water) the connectivity between Al ions maintained mainly by co-ordinate bonds through organic (mainly acetate) ions. However in the hydrogel formed by water, more than 85% of the Al ions are proved to be involved in bonds established by shared OH, O and acetate ions.

Figure 3. Coordination of acetate ion
Acetate ions can co-ordinate around Al in various ways (Fig 3). The bidentate bridging position is the most possible one on the basis of other as well as our data. I found the acetate ions to be of significance in the formation of stable gel-like products as they occupy some fraction of co-ordination sites and hinder in this way the precipitation. Furthermore the various organic anions play role in building of the gel-structure.
Based on the scattering experiments, I proposed models for the different supramolecular structure evolved in the different products. In Fig 4 the proposed models are shown indicating the Al rich regions (aggregates), since by X-ray techniques these regions can be „seen”. During hydrolysis isometric units form with diameter of about 20 Å. Evaporating the excess solvent accompanied by the strong increase of viscosity a practically continuous, loose network grows up showing middle-range ordering. During further drying this ordered structure does not change, although larger inhomogeneities arise, which I identified as pores filled by gaseous products of the chemical processes keeping going even in this step.

Figure 4. Models for supramolecular structure
In the hydrogel at high mass ratio of water large particles are present,
which cause opalescence. These particles are build up from cylindrical
oligomers. However during drying, below certain ratio of water denser aggregates
with more ordered structure can be unambiguously shown. I proved by rehydrating
the xerogel (that is preparing hydrogel again by adding water to it) that
the formation of these more ordered aggregates is irreversible. These units
build up the structure of the elastic gel connecting together by H-bonds.
Between these aggregates of some hundreds Å smaller pores can be
observed, the sizes of those depend on the amount of water in the gel.
Publications
R. Mezei, K. Sinkó: Preparation Of An Aluminum Oxo-Hydroxide Gel In Organic Medium, Coll. Polym. Sci. 274 (1996) 1054K. Sinkó, R. Mezei, L., Cser, Gy. Káli, P. Fratzl: SAS Experiments On Inorganic Gels, Physica B, 234 (1997) 279
K. Sinkó, R. Mezei, J. Rohonczy, P. Fratzl: Gel Structures Containing Al(III) Langmuir, 1998, accepted
K. Sinkó, R. Mezei: Effect of preparation condition on sol-gel preparared aluminosilicate gels, J. Non-Cryst. Solids, 231 (1998) 1
R.Mezei, T. Karancsi, K. Sinkó: Chemical processes involved in the sol-gel preparation of an aluminum oxo-hydroxide gel from aluminum nitrate J. Mater. Chem. 8 (1998) 2095
| Vissza a tartalomjegyzékhez
Back to Contents |
Vissza a PhD-tézisek tartalomjegyzékhez
Back to PhD theses list |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |