

1. ábra
Péter Mária
Aminocsoportot tartalmazó vegyületek királis megkülönböztetése
Szegedi Tudományegyetem,
Gyógyszerkémiai Intézet
2000.
1. Elõzmények és célkitûzések
A sztereokémia történetének mintegy 150 éve
alatt számtalan példa gyûlt össze annak bizonyítékaként,
hogy a királis gyógyszerek enantiomerjei között
például biológiai aktivitásukban, transzport
mechanizmusukban és
metabolizmusukban lényeges különbségek állhatnak
fenn. A hatásos izomer mellett az antipód inaktív,
vagy akár káros hatású is lehet. Sokáig
a szintetikus királis gyógyszerek többsége mégis
racemátként került forgalomba.
A kiralitás fontosságának ezirányú felismerése az enantiomer-tiszta vegyületek elválasztására, ill. elõállítására alkalmas, az elméleti érdekességen messze túlmutató, gyakorlati jelentõségû sztereoszelektív módszerek robbanás-szerû fejlõdését eredményezte az elmúlt évtizedben. Ezek közül kiemelkedõ szerepet játszanak a biokatalitikus átalakítások és a folyadékkromatográfiás technikák.
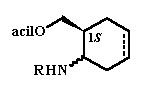
Jelen munka célja egyszerû, könnyen hozzáférhetõ módszerek kifejlesztése volt szintetikus és gyógyszerkémiai szempontból egyaránt fontos, aminocsoportot tartalmazó racém vegyületek enantiomerjeinek elválasztására (1. ábra).
Célul tûztük ki a kinetikus enzimes rezolválás alkalmazását enantiomer-tiszta 1,3-aminoalkoholok elõállítására. Ehhez elengedhetetlen feltétel volt, hogy megfelelõ enantioszelektív analitikai módszert találjunk a reakciók követésére.
Másik fõ célunk volt egy új királis derivatizálószer szintézise és alkalmazása az 1. ábrán bemutatott vegyületek enantiomerjeinek HPLC-vel történõ szeparálására.


1. ábra
2. Kísérleti módszerek
A munka során felhasznált racém vegyületeket részben irodalmi források alapján szintetizáltuk, részben kereske-delemben kaphatók.
Az enzim-katalizált reakciók elõkísérleteit milligrammos méretben végeztük, követésükre királis HPLC oszlopot használtunk. A gramm mennyiségû rezolválásokkal elõállított új vegyületeket optikai forgatás, NMR, MS és elemi analízis adatokkal jellemeztük.
A kifejlesztett származékképzõ reagens alkalmazása során keletkezõ diasztereomereket hagyományos fordított fázisú HPLC oszlopokon választottuk el.
3. Eredmények és értékelésük
Ciklusos 1,3-aminoalkoholok enzimes rezolválása és HPLC elválasztása
3.1. A reakciókörülmények (oldószer,
acildonor, védõcsoport, enzim) optimalizálásával
sikeresen rezolváltunk ciklusos
1,3-aminoalkoholokat (14) Z-származékaik
lipáz-katalizált
O-acilezésén keresztül különbözõ
éter típusú oldószerekben vinil-butirát
jelenlétében (2. ábra). Az alkalmazott enzimek többsége
a Kazlauskas-szabállyal összhangban S szelektivitást
mutatott. A gramm mennyiségû rezolválások után
az átala-kulatlan alkohol, valamint acilezõdött észter
enantiomereket egyaránt 90%-nál nagyobb enantiomer-tisztasággal
nyertük
[1, 3].
 |
|
 |
+
|
 |
|
|
|
|
2. ábra
3.2. A cellulóz trisz(3,5-dimetil-fenil-karbamát) (Chiralcel OD) királis állófázison végzett direkt analízisek lehetõvé tették a lipáz-katalizált folyamat eredményeként a reakcióelegyben jelenlévõ mind a négy izomer (két alkohol és két észter enantiomer) egyidejû elválasztását. Így az oszlop kiválóan alkalmasnak bizonyult az enzimes reakciók gyors és egyszerû követésére. Az 1a4a vegyületek enantiomerjeit egy kolonna elõtti származékképzõ segítségével is szeparáltuk [2, 3].
Új izotiocianát típusú királis derivatizálószer szintézise és alkalmazása
3.3. Primer és szekunder aminocsoportot tartalmazó vegyületek indirekt HPLC elválasztására új izotiocianát típusú reagens, az (1S,2S)- vagy (1R,2R)-1,3-diacetoxi-1-(4-nitro-fenil)-2-propilizotiocianát [(R,R)- vagy (S,S)-DANI, 3. ábra] szintézisét valósítottuk meg.
Kiindulási anyagul egy, a klóramfenikol gyártás inter-medierjeként ismert amino-propán-diolt választottunk, mely ilyen módon mindkét enantiomer formában, optikailag tisztán és nagy mennyiségben állt rendelkezésre. A reagens egyszerû kétlépéses reakcióval állítható elõ enantiomer-tiszta formában (3 99,5%); stabil kémiailag és sztereokémiailag szilárd és oldat fázisban is. Mivel mindkét enantiomer formában hozzáférhetõ, lehetõvé teszi az elúciós sorrend megfelelõ megválasztását, mely enantiomer-tisztaság meghatározásakor kulcsfontosságú lehet (4. ábra).
A származékképzési reakciót a 3. ábra mutatja be (S,S)-DANI esetén. A derivatizálás során képzõdõ tiokarbamid kromofór érzékeny UV detektálást tesz lehetõvé függetlenül a derivatizálandó anyag saját UV aktivitásától.
A származékképzés kinetikáját részletesen tanulmányoztuk a-aminosavak és b-blokkolók esetében. A reakciókörülmények (pH, reagensfelesleg, hõmérséklet, reakció idõ) optimali-zálásával biztosítottuk a derivatizáció kvantitatív lejátszódását a különbözõ vegyületcsoportok esetében [4, 7].

3. ábra
3.4. A tiokarbamid diasztereomerek HPLC analízise az esetek többségében az alkalmazott szerves módosítók lényeges szelektivitásbeli különbségét tette nyilvánvalóvá: a metanol sokkal hatékonyabb volt a retenciós idõk és a felbontások tekintetében is az acetonitrilnél.
Tanulmányoztuk a származékok elúciós sorrendjét, de általános szabályszerûséget nem tudtunk megállapítani. A várakozásnak megfelelõen az ellentétes reagens enantiomer alkalmazásakor az elúciós sorrend megfordult (4. ábra) [4-7].

5. ábra
3.5. Összefoglalva megállapítható, hogy az új reagens jól alkalmazhatónak bizonyult a legtöbb vizsgált primer és szekunder aminocsoportot tartalmazó vegyület elválasztására (1. táblázat).
1. táblázat

A szerzõ köszönetet mond témavezetõjének, Dr. Fülöp Ferenc tanszékvezetõ egyetemi tanárnak, munkája irányításáért.
Chiral discrimination of compounds possessing an amino group
Ph.D. Thesis
Institute of Pharmaceutical Chemistry
University of Szeged
2000
Enzymatic resolution and HPLC separation of racemic cyclic 1,3-amino alcohols
1. Cyclic 1,3-amino alcohols (14) have been successfully
resolved via lipase-catalysed O-acylation of their Z derivatives,
using vinyl butyrate as acyl donor in different ether solvents (Figure
1). Most of the screened lipases preferred the S enantiomer in accordance
with the Kazlauskas rule. Both alcohol and ester enantiomers were obtained
in ee>90% after gram-scale resolutions [1, 3].
 |
|
 |
+
|
 |
|
|
|
|
Figure 1
2. Direct HPLC analyses on a cellulose tris(3,5-dimethyl-phenylcarbamate)
(Chiralcel OD) CSP allowed the separation of all four possible isomers
produced in enzymatic reactions in a single run, and therefore proved suitable
for the monitoring of the resolutions. Enantiomers of 1a4a
were additionally separated as their FDAA derivatives under reversed-phase
conditions [2, 3].
Synthesis and application of a novel isothiocyanato-type chiral derivatizing agent (CDA)
3. A new isothiocyanato-type CDA, (R,R)- or (S,S)-DANI, was designed for the indirect HPLC enantioseparation of primary and secondary amino compounds.
As starting compound, an amino-propanediol derivative was chosen, which is an intermediate of chloramphenicol synthesis. Therefore, both enantiomers are available in chirally pure form in large quantities. The new reagent can be readily synthetized in enantiomerically pure form (3 99,5%) after a straightforward two-step synthesis. It is stable chemically and stereochemically both in the solid and in the solution phase. It is available in both enantiomeric forms, allowing the appropriate selection of the elution sequence.
The derivatization with (S,S)-DANI is depicted in Figure 2. The thiourea chromophore generated in the course of derivatization permits sensitive UV detection of the derivatives; the lack of inherent chromophoric properties of the analytes cannot prevent detection.

Figure 2
The kinetics of derivatization was studied in detail for a-amino acids and for b-blockers. The quantitativeness of reactions was ensured by optimization of reaction conditions (pH, reagent excess, temperature) [4, 7].
4. As concerns the HPLC analyses of the thiourea derivatives formed, significant differences were found between the selectivities of the organic modifiers applied; in most cases, MeOH proved much more effective than MeCN with respect to both retention times and resolutions.
The sequence of elution of the diastereomers was studied, but no general rule could be found. As expected, the elution sequence changed when the opposite reagent enantiomer was applied for derivatization (Figure 3) [4-7].
5. In conclusion, the new CDA was capable of the resolution of most of the investigated analytes (Table 1).

Figure 3
Table 1

Publications
1. M. Péter, J. Van der Eycken, G. Bernáth, F. Fülöp:
Enzymatic resolution of alicyclic 1,3-amino alcohols in organic media;
Tetrahedron: Asymmetry 1998, 9, 23392347.
2. M. Péter, A. Péter, J. Van der Eycken, P. Csomós,
G. Bernáth, F. Fülöp: High-performance liquid chromato-graphic
separation of cyclic 1,3-amino alcohol derivatives; J. Chromatogr. A
1998, 816, 123129.
3. Péter M., Bernáth G., Fülöp F., Van der
Eycken J.: Ciklusos 1,3-aminoalkoholok enantiomerjeinek enzimes és
folyadékkromatográfiás elválasztása;
Magy. Kém. Foly. 1999, 105, 6170.
4. M. Péter, A. Péter, F. Fülöp: Development
of new isothiocyanate-based chiral derivatizing agent for amino acids;
Chromatographia 1999,
50, 373375.
5. M. Péter, A. Péter, F. Fülöp: Application
of (1S,2S)- and (1R,2R)-1,3-diacetoxy-1-(4-nitrophenyl)-2-propyl
isothio-cyanate to the indirect enantioseparation of racemic proteinogenic
amino acids;
J. Chromatogr. A 2000, 871, 115126.
6. M. Péter, F. Fülöp: Indirect high performance liquid
chro-matographic enantioseparation of racemic amino alcohols with 1,3-diacetoxy-1-(4-nitrophenyl)-2-propyl
isothio-cyanate as derivatizing agent; J. Liq. Chromatogr. RT 2000,
23, 24592473.
7. M. Péter, Á. Gyéresi, F. Fülöp: Liquid
chromatographic enantioseparation of b-blocking
agents with (1R,2R)-1,3-diacetoxy-1-(4-nitrophenyl)-2-propyl
isothiocyanate as chiral derivatizing agent; J. Chromatogr. A 2001,
910,
247253.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |