23. ábra
Molekuláris oldatkémia
A rácsmodellektõl a molekuladinamikai konfigurációkig
Pálinkás Gábor
a Magyar Tudományos Akadémia levelezõ
tagja
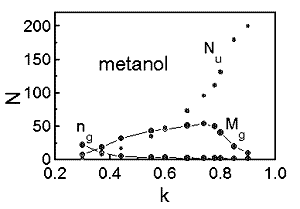
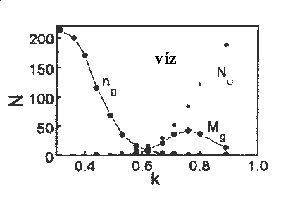
A 23.ábrán jobbra szobahõmérsékletû víz hidrogénhíd hálóinak átlagos méretét ng, számát Mg és a monomerek számát Nu láthatjuk a k kötésenergia paraméter függvényében egy 200 molekulát tartalmazó térfogatrészben. A k paraméter értékének csökkentésével egyre kisebb energiával kölcsönható partnereket is kötöttnek tekintünk. Látható, hogy a k csökkenésével a monomerek száma lecsökken és a maximális kötési energia felénél, 2.5 átlagos kötésszám felett a hálóméret hirtelen megnõ és azt követõen lefedi az egész rendszert. Mivel az egy molekulára jutó hidrogénkötések száma a legpesszimistább kísérleti becslés alapján is 2.5 felett van. Megállapíthatjuk, hogy a víz úgy tekinthetõ mint egy tranziens gél. Tranziens azért, mert a kötések élettartama pikoszekundum nagyságrendû. Az erõsen kölcsönható molekulák az egész térfogatra kiterjedõ összefüggõ hálót képeznek a molekuladinamikai modellekben.


23. ábra
A fentiektõl eltérõen viselkednek azonban a metanol
molekulahálói (23.ábra, balra).
A kötés definíciójának szigorításával
itt is megindul a monomerek számának csökkenése,
a hálóméret növekedése, de a leggyengébb
kötésdefiníció esetében is – az összes
elsõszomszédot (max. 3) kötésben levõnek
tekintve- a hálóméret véges marad és
nem haladja meg a 20 molekulára kiterjedõ méretet.
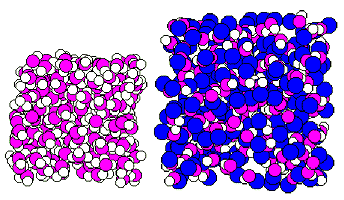
Az ok jól látható a 24.ábrán, ahol a
víz és a metanol 200 molekulát tartalmazó molekulahalmazait
láthatjuk. A metanolban a metilcsoportok hibahelyeket képeznek,
gátolják a hidrogénkötéseket. A víz
hálója kompakt, és összefüggõ, míg
a metanol kötéshálói lazák és alhálókra
esnek szét.
24. ábra
Meg kell említenem, hogy hasonlóan a metanolhoz, az N-metil-formamidban, a hangyasavban a hidrogénkötéses molekulahálók átlagos mérete szintén véges. Ugyanakkor azonban például a folyadék argon (81 K), az aceton, a dimetil-szulfoxid viszonylagrelatív erõs intermolekuláris kötései a vízhez hasonlóan az egész folyadékra kiterjedõ összefüggõ hálót alkotnak. A szupramolekuláris szervezõdés tekintetetében az olyan folyadékok az általánosak, amelyeknek molekulái térbeli intermolekuláris kötésre képesek, és azok a folyadékok a különösek, amelyekben az erõs intermolekukuláris kötések bizonyos irányokban gátoltak.
Végezetül, egy igen fontos fizikai-kémiai tulajdonságról, elegyek többlettulajdonságairól szeretnék beszélni. Ismere-retes, hogy számos elegy többlettulajdonságai az elegyarány meghatározott értékénél szélsõértéket mutatnak. .Ez figyelhetõ meg a víz-metanol elegyeknél is 3:1 víz-metanol mólaránynál. Szélsõértéke van a moláris többlet entalpiának, térfogatnak, izotermikus kompresszibilitásnak, maximális az állandó térfogatú fajhõ, és minimális a víz és metanol molekulák diffúziós állandója.
Az 1. táblázatban a molekuladinamikai konfiguráció-kon számított moláris többletenergiát és diffúziós állandókat tüntettem fel a kísérleti adatokkal összehasonlítva( a moláris entalpia számértékben alig különbözik a moláris energiától, a pdV kicsi és csak a második jegyben okoz eltérést). Az energia maximuma és a diffúziós állandók minimuma 3:1 víz-metanol mólaránynál figyelhetõ meg mind két adatsorban. A többlettulajdonságok extremum viselkedését az irodalom általában valamilyen szerkezeti változásra, pl. ciklikus dimérek keletkezésére, vagy klatrátszerkezet kialakulásával magyarázza.
1. táblázat
Víz–metanol elegyek többlettulajdonságai
DX = X – aVXV– amXm
| xm | –DE | –DH | –DDV | –DDV | –DDm | –DDm |
| kJmol–1 | kis | 10–5cm2s–1 | kis | kis | ||
| 0.10 | 0.33 | 0.60 | 0.40 | 0.60 | 1.20 | 1.11 |
| 0.25 | 1.06 | 0.90 | 0.60 | 0.90 | 1.50 | 1.33 |
| 0.90 | 0.22 | 0.26 | 0.43 | 0.62 | 0.40 | 0.46 |
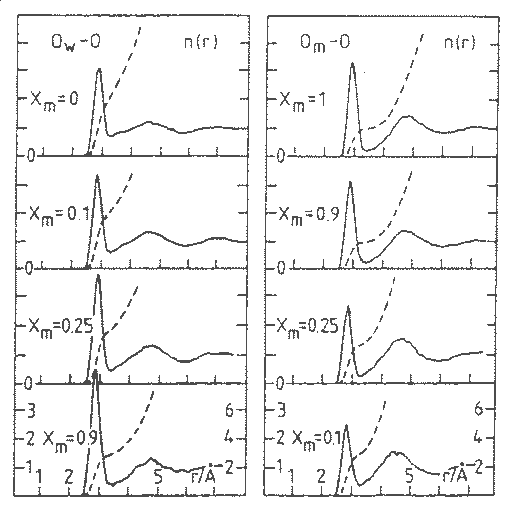
Ezzel szemben ha megnézzük, a molekulák térbeli eloszlását jellemzõ páreloszlás függvényeket (25.ábra), semmi specifikus nem látható, a változások a móltört függvényében folytonosak. Az elsõ oszlop a vízmolekula oxigénjei körüli, a második a metanolmolekula oxigénjei körüli szomszédok oxigénjeinek páreloszlás függvényeit (Ow-O, Om-O) mutatja be függetlenül attól, hogy ezek szomszédok metanol- vagy vízmolekulák.
25. ábra
A metanol mólarányának növelésével
a vízmolekulák körüli oxigének korrelációja
erõsödik, az elsõ csúcs amplitúdója
nõ, a koordinációs szám folytonosan 3-ra csökken.
Fordítva, a metanol esetében, a vízmolekulák
mólarányát növelve , a korreláció
az elsõ szomszédok között gyengül, a metanolmolekulák
szomszédjainak átlagos száma 2-rõl háromra
nõ.
Van azonban érdekesség az elegyek molekulahálóinak topológiai jellemzõiben (2. táblázat). A táblázatban szereplõ adatok egy 200 molekulát tartalmazó rendszerrészre vonatkoznak. A kötés definíciójában a kötési energia felsõ korlátja -15 kJmol-1 volt minden rendszerben azonosan az összehasonlíthatóság miatt.
2. táblázat
Hálóméret-eloszlás víz–metanol elegyekben
| xm | Mg | ng |
| 0 | 2.5 | 81.3 |
| 0.10 | 1.5 | 139 |
| 0.25 | 1.1 | 195 |
| 0.90 | 9.6 | 21 |
| 1 | 32.1 | 5.8 |
| a rendszerrészlet mérete 200 molekula | ||
A víz-metanol elegyek moláris többlettulajdonságainak
3:1 mólarány közelében fellépõ
szélsõértékei egyszerûen magyarázhatók
az elegyek molekulahálóinak átlagos méreteivel.
A vízhez metanolt adagolva háló rekonstrukció
indul meg, a molekulaháló összefüggõsége
erõsödik, a hálóhibahelyek száma csökken.
A 3:1 víz-metanol mólarány közelében a
rekonstrukció befejezõdik, a hidrogénkötések
száma maximális. Tovább növelve a metanolmolekulák
arányát, a hálóhibahelyek száma növekedni
kezd, a háló összefüggõsége gyengül.
Metanolban gazdag elegyekben a hálók átlagos mérete
már csak 10-20 molekula. A jelenséget a metanol-víz
hidrogénkötések keletkezésének és
metilcsoport hálóhibahelyek számát növelõ
hatásának versengése okozza. Számos más
elegy többlettulajdonságainak szélsõértékei
is hasonló módon értelmezhetõk.
A bemutatott példákban megfigyelhetõ jelenségek megerõsítik azt a meggyõzõdést, hogy a folyadékokban a rövid távú rendezettség és hosszú távú rendezetlenség mellett jelentõs szerep jut a rövid távú rendezetlenségének és hosszú távú szervezettségének is.
Következô rész
Vissza a tartalomjegyzékhez